课程说明¶
程旭 教授 有机副主任 主要负责应化的课程教学 朱从青
教材 "邢大本" 作业 胡洪文 南大 作业 有机化学习题册 南大/北大 一次期中考试 一次期末考试 闭卷 教学内容多 时间紧 导致没有习题课 不做练习不会做题, 空着写不了 课程紧张, 可能需要补课[可以课后学习]
大学化学
inorganic chemistry即无机化学有机化学
organic chemistry
Why organic chem?
- 以前认为生命体才有
- 直到人工合成氨
第一章 链烷烃 环烷烃 构象¶
第一部分 链烷烃
第一节 链烷烃的结构特征¶
- 烷烃分子中的C都是sp^3杂化
\sigma键¶
在化学中, 两个轨道沿着轨道方向沿对称轴方向重叠形成的键叫\sigma键
特点
- 电子云可以达到最大程度的重叠, 因此比较稳定
- \sigma键可旋转
烷烃的命名:¶
Nomenclature
IUPAC命名法
CH_3-CH_2-CH_3 CH_3CH_2CH_3 键线式
第二节 链烷烃的异构现象¶
构象¶
一个已知构型的分子, 仅由于单键的旋转而引起分子中的原子或集团在孔家南大特定排列形式称为构象
构象异构体¶
单键旋转时会产生无数个构象, 这些构象互为构象异构体(或称旋转异构体)
乙烷的构象¶
两面角\phi- 0^o
重叠式构象 - 60^o
交叉式构象 - 0-60^0
扭曲式构象
乙烷交叉式构象和重叠式构象的表示方法¶
常用: 伞式
乙烷交叉式构象和重叠式构象的能量分析¶
能量和距离相关, 角度的影响也最终转换为距离的影响
能量: 重叠式 > 交叉式 \Delta E \approx 12 kJ
乙烷构象势能关系图¶
- 非键连相互作用: 不直接相连的原子间的排斥力
- 稳定构象: 位于势能曲线低谷的构象
丁烷¶
正丁烷的极限构象及符号说明¶
正丁烷的构象势能关系图¶
正丁烷的能量分布¶
能量越低, 出现的概率越大.
第三节 烷烃的物理性质¶
熔点¶
取决于分子间的作用力和晶格堆积的密集度
沸点¶
- 一般很低, 非极性, 只有色散力
- 随相对分子质量增大而增大(运动能量增大, 范德华引力增大)
- 叉链多, 沸点低(叉链多, 分子不易接近)
密度¶
均小于1
第四节 链烷烃的化学性质¶
总体特点¶
-
稳定. 对强酸, 强碱, 强氧化剂都不发生反应.
-
烷烃的多数反应都是通过自由基机理进行的.
1. 自由基¶
-
定义: 带有孤电子的源自或原子团称为自由基
-
碳自由基
-
三种可能的结构:
-
刚性
-
翻转
-
平面
-
-
自由基的产生
-
热均裂产生: O-O键受热断裂
-
辐射均裂产生: Br_2光解
-
单电子转移的氧化换元反应产生
-
-
自由基的稳定性
解离能
共价键均裂时所需的能量称为键解离能.
键解离能越小, 形成的自由基越稳定.
Note
影响自由基稳定的因素:
碳自由基是最外层7电子结构, 因此是亲电的, 从而达到八隅体.
2. 自由基反应¶
-
定义: 由化学键均裂引起的反应称为自由基反应.
-
共性:
1.反应机理包括链引发, 链终止, 链增长
2.反应必须在光, 热或自由基引发剂的作用下发生
注: 现已被打破
3.溶剂的极性, 酸, 或碱催化剂对反应无影响
4.氧气是自由基反应的抑制剂.
注: 也有问题.
Note
单自由基比双自由基更稳定.
3. 过渡态理论¶
任何一个化学反应都要经过一个过渡态才能完成.
-
过渡态的特点:
-
能量高
-
极不稳定, 不能分离得到
-
旧键未完全断开, 新键未完全形成.
-
-
反应势能图:
-
反应势能曲线
-
反应坐标(反应路径): 由反应物到生成物所经过的能量要求最低的途径.
-
过渡态: 与势能最高点对应的结构称为过渡态.
-
活化能: 由反应物转变为过渡态所需的能量.
-
中间体: 两个过渡态之间的产物称为中间体.(中间体能分离得到, 过渡态不可分离得到)
-
Hammond假设: 过渡态总是与能量相近的分子结构相似.
其实是
结构相似->能量相近
注意
产物的势能一定是低于反应物的.
-
4. 烷烃的卤化¶
(1)甲烷的氯化
-
反应式
-
反应机理:
-
链引发
-
链增长
-
链终止
-
(2)甲烷卤化反应的比较
-
氯化反应难以控制(释放能量大, 同时产物也很稳定)
-
碘化反应一般不用. 碘自由基是不活泼的自由基.
-
氯化和溴化反应常用, 氯化比溴化反应快5万倍.
(3)烷烃氯化反应的选择性
5. 链烷烃的制备¶
见卤代烃的金属有机化合物部分
第二部分 环烃
第一节 环(烷)烃的分类¶
第二节 单环烷烃的分类和同分异构¶
环烷烃的命名
-
多个不同基团: 按英文的首字母先后
-
环:
cyclo -
桥环: bicyclo
...
第三节 物理性质¶
第四节 环烷烃的化学性质¶
大环, 中环化合物的化学性质与链烷烃相似.
小环和普通环化合物的性质对比如下:
-
与氢反应: 三元环比四元环更容易开环.Pt比Ni的催化活性更强.
-
与氯和溴反应
-
与氢碘酸反应
-
氧化反应
第五节 张力学说¶
解释为什么三四元环容易开环
通过热力学的角度研究张力能, 燃烧热的数据表明, 五元和五元以上的环烷烃都是稳定的.
第六节 环形化合物的构象¶
环己烷构象¶
环己烷的构象
1. 椅式构象¶
1.环己烷椅式构象
-
锯架式
-
纽曼式
2.构象特点
-
6个a(axial)键, 6个e(equatorial)键.
-
有C_3对称轴
-
有
构象转换体.
椅式构象是环己烷的优势构象(稳定构象).
2. 环己烷的船式构象¶
- 重叠式多, 能量高
椅式构象 vs. 船式构象
构象分布 椅式构象 : 船式构象 = 10000 : 1
3. 扭船式构象¶
例: 顺-1,4-二叔丁基环己烷
4. 半椅式构象¶
只能取船型的有机物
桥环烷
一取代环己烷的构象¶
取代基的e键构象和a键构象具有能量差, 会导致构象分布变化.
二取代环己烷的构象¶
1,2-二取代环己烷¶
-
顺式: 1a1e, 两种情况 能量相等
-
反式: 2a/2e 能量不等.
1,3-二甲基环己烷¶
-
顺式: 2a/2e 能量不等, 双平伏键更稳定
-
反式: 1a/1e 两种情况 能量相等
为什么平伏键比直立键更稳定
因为平伏键是指向环的外侧,与其它基团之间的距离相对较远,电子之间的排斥作用力较小,稳定性较大;直立键是与环的中心轴平行的,与间位的直立键之间的距离较近,如果连上基团时,基团之间的电子作用力较大,稳定性下降。所以取代基连在平伏键比连在直立键上要稳定。
有两个不同取代基的环己烷衍生物¶
两个规则¶
Hassel规则¶
Barton规则¶
四元环¶
-
平面式
-
折叠式
五元环¶
-
信封式
-
半椅式
十氢合萘的构象¶
双环: 把一个环当做主环, 另一个当做环上的取代基
- 顺十氢合萘
一个直立椅式构象, 一个平铺椅式构象.
- 反十氢合萘
第二章 烯烃¶
第一节 结构特征¶
-
sp2杂化
-
\pi键是由p轨道侧面重叠而成
-
由于室温下双键不能自由旋转, 所以有Z, E异构体.
第二节 烯烃的命名¶
命名规则
先找主链, 取双键顺序最小的一侧开始对碳原子排序号
顺饭结构: 大基团同侧 / 大基团异侧
亚基¶
有两个自由价的基称为亚基.
第三节 烯烃的反应¶
加成反应¶
定义: 两个或多个分子相互作用, 生成一个加成产物的反应.
分类: 自由基加成 离子型加成 环加成
亲电加成反应机理的归纳¶
(1)环正离子中间体(反式加成)
(2)离子对中间体(顺式加成)
(3)碳正离子中间体(顺式加成)和(反式加成)
(4)三分子过渡态(反式加成)
烯烃与卤素的加成¶
反应机理
注意理解箭头的画法.
烯烃与氢卤酸加成¶
\sigma-超共轭作用
区位选择性问题¶
区位选择性
区位专一性
马尔科夫尼科夫规则
Summary
烯烃与HX的加成反应, 具有区位选择性, 在绝大多数的情况下, 符合马氏规则.
马氏规则: H原子加成在C原子所连H原子多的一端.
重排问题¶
通过重排, 产生更多的超共轭作用.
反应的立体选择性问题¶
烯烃与水/硫酸/有机酸/醇/酚的反应¶
在合成中的应用不同
加水制醇, 加醇/酚制醚, 加酸制酯.
烯烃与次卤酸的加成¶
烯烃的自由基加成¶
烯烃受自由基进攻而发生的加成反应称为自由基加成反应.
卡拉施反应¶
烯烃的氧化¶
烯烃的环氧化反应¶
-
环氧化反应是顺式加成, 环氧化合物仍保持原烯烃的构型
-
产物是对称的, 只有一个产物, 产物是不对称的, 产生一对旋光异构体
-
当双键两侧空阻不同时, 从空阻小的一侧进攻.
烯烃被KMnO_4和OsO_4氧化¶
在酸性/浓,热条件下, 高锰酸钾能将碳碳双键完全断裂
烯烃的臭氧化反应¶
烯烃的硼氢化反应¶
BH_3硼烷
硼氢化-氧化->形成醇
硼氢化-质子化->形成烷烃
B_2H_6 桥键
特点:
-
立体化学: 顺式加成(烯烃构型不会改变)
-
区域选择性: 反马氏规则
-
不会有重排反应的产生
烯烃的催化氢化¶
烯烃与卡宾的反应¶
卡宾: 电中性的含二价碳的化合物称为卡宾. 是一种能瞬间存在 但不能分离得到的活性中间体 (能得到, 能分离出晶体).
烯烃的聚合反应¶
烯烃的\alpha-卤化¶
第五节 烯烃的消除¶
扎伊切夫规则
当反应能生成异构的烯烃时, 总是倾向于生成取代基较多的烯烃.(取代基比较多的烯烃比较稳定)
重排
E1消除 E2消除
反应的竞争问题¶
- 低温利于分子间失水
- 高温利于分子内失水
第三章 卤代烷¶
卤代烃的分类和命名¶
卤代烷的结构¶
卤代烷的构象¶
卤代烷物理性质¶
卤代烃化学性质¶
预备知识¶
电子¶
诱导效应
因分子中原子或基团的极性(电负性)不同而引起成键电子云沿着原子链向某一方向移动的效应称为诱导效应.
特点:
-
沿着原子链传递
-
很快减弱(3个原子)
诱导拉电子:
诱导给电子:
共轭效应
共轭体系: 单双建交替出现的体系.
定义: 在共轭体系中, 由于原子间的一种相互影响而使体系内的\pi电子(或p电子)分布发生变化的一种电子效应.
特点:
-
只能在共轭体系中
-
[TODO]
超共轭效应
\sigma键在旋转的过程中与p键(或\pi键)处于共轭位置, 也会产生电子的离域现象.
特点:
-
超共轭效益比共轭效应若得多
-
[TODO]
碳正离子¶
亲核取代反应¶
有机化学物分子中的原子或原子团被亲核试剂取代的反应称为亲核取代反应.
构型保持和构型翻转
S_N 2反应¶
S_N 1反应¶
只有一种分子参与了反应速度关键步骤的亲核取代反应.
反应机理:
-
C-X键伸长, 形成中间体1. X^-离去, 得到碳正离子
-
C+离子sp^2杂化, 结合亲核试剂(从两侧进攻), 形成两种中间体过渡态
-
...
反应伴随消除和重排反应.
例: 溶剂解反应
影响亲和取代反应的因素¶
1.空间效应
V_{3°RX} > V_{2°RX} > V_{1°RX} > V_{CH_3X}
1°RX
根据与卤原子直接相连碳原子的不同,分为一级卤代烃RCH2X、二级卤代烃R2CHX和三级卤代烃R3CX。
结论:
V_{3°RX}, V_{2°RX }\to S_N2
V_{CH_3X}\to S_N1
2.离去基团
离去基团稳定阴离子能力越强, 其共轭酸的酸性越强(H+越容易电离), 离去能力越强, 对S_N1, S_N2反应越有利.
取代所需断键的解离能越低, 越易离去.
离子基团碱性越弱, 越易离去.
同第一点.
如何使羟基转变成一个好的离去基团?
-
加水(H+)
-
用Zncl_2=>大号H+
3.溶剂对亲核取代反应的影响
溶剂分类:
-
质子溶剂: MeOH EtOH
-
偶极溶剂: 正电荷中心和负电荷中心明显分离, 呈现出偶极性
-
极性溶剂: 正负电荷中心分离, 但是没有达到偶极溶剂的程度
-
非极性溶剂: 非极性
4.试剂亲核性的影响
碱性 vs. 亲核性
碱性: A- + H+ = A-H
亲核性: A- + C+ = A-C
与软硬酸碱理论有关.
多数情况正相关, 少数情况(与碳正离子所连基团的位阻有关)碱性越强, 亲核性越弱.
5.碘离子
利用碘离子的强亲核性和易离去性质, 进行取代.
[TODO]截屏PPT
6.两位负离子
氰化钠
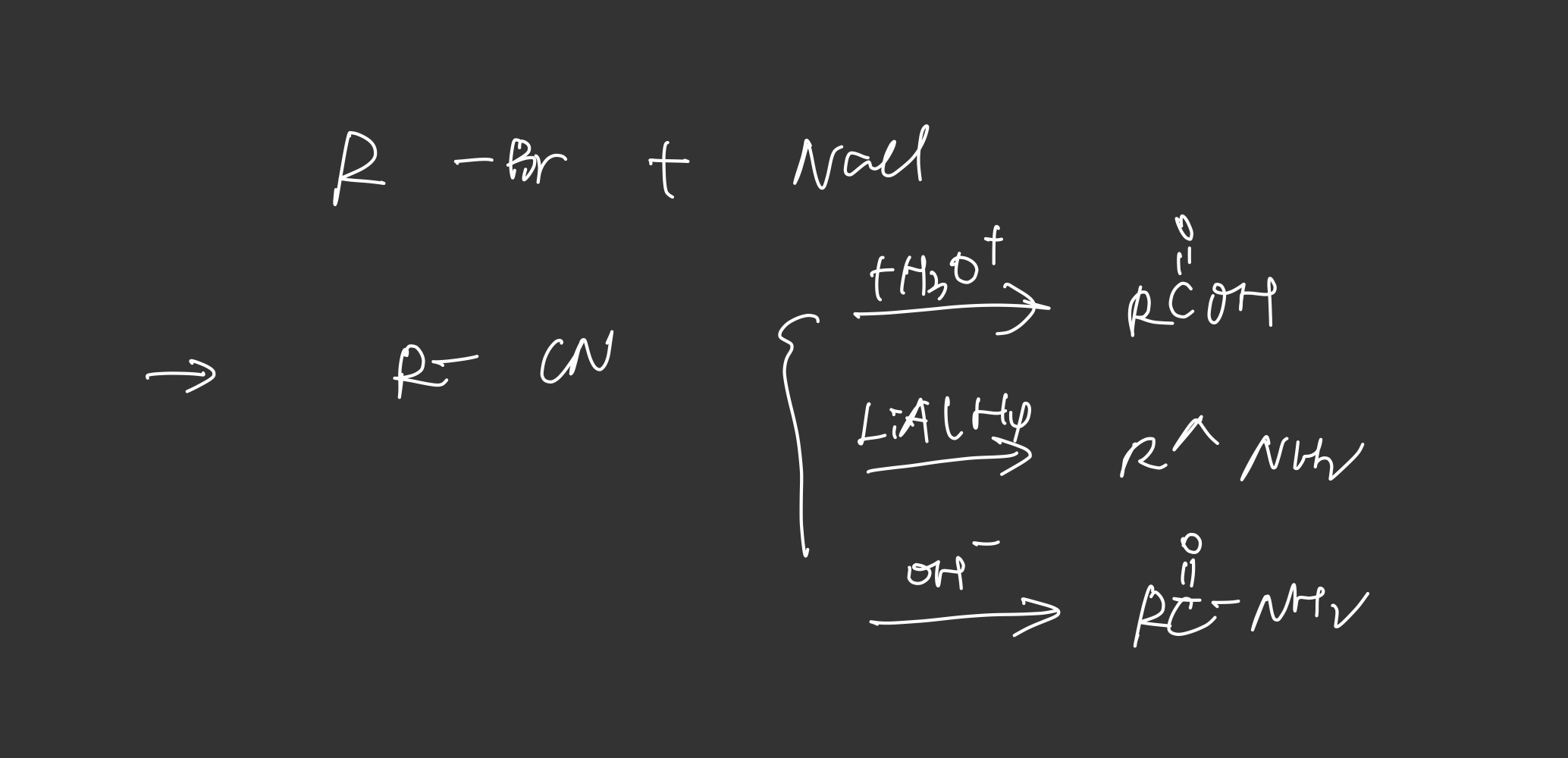
成环的S_N2反应¶
卤代烃的还原¶
卤仿的分解¶
卤代烷的制备¶
韦提希反应
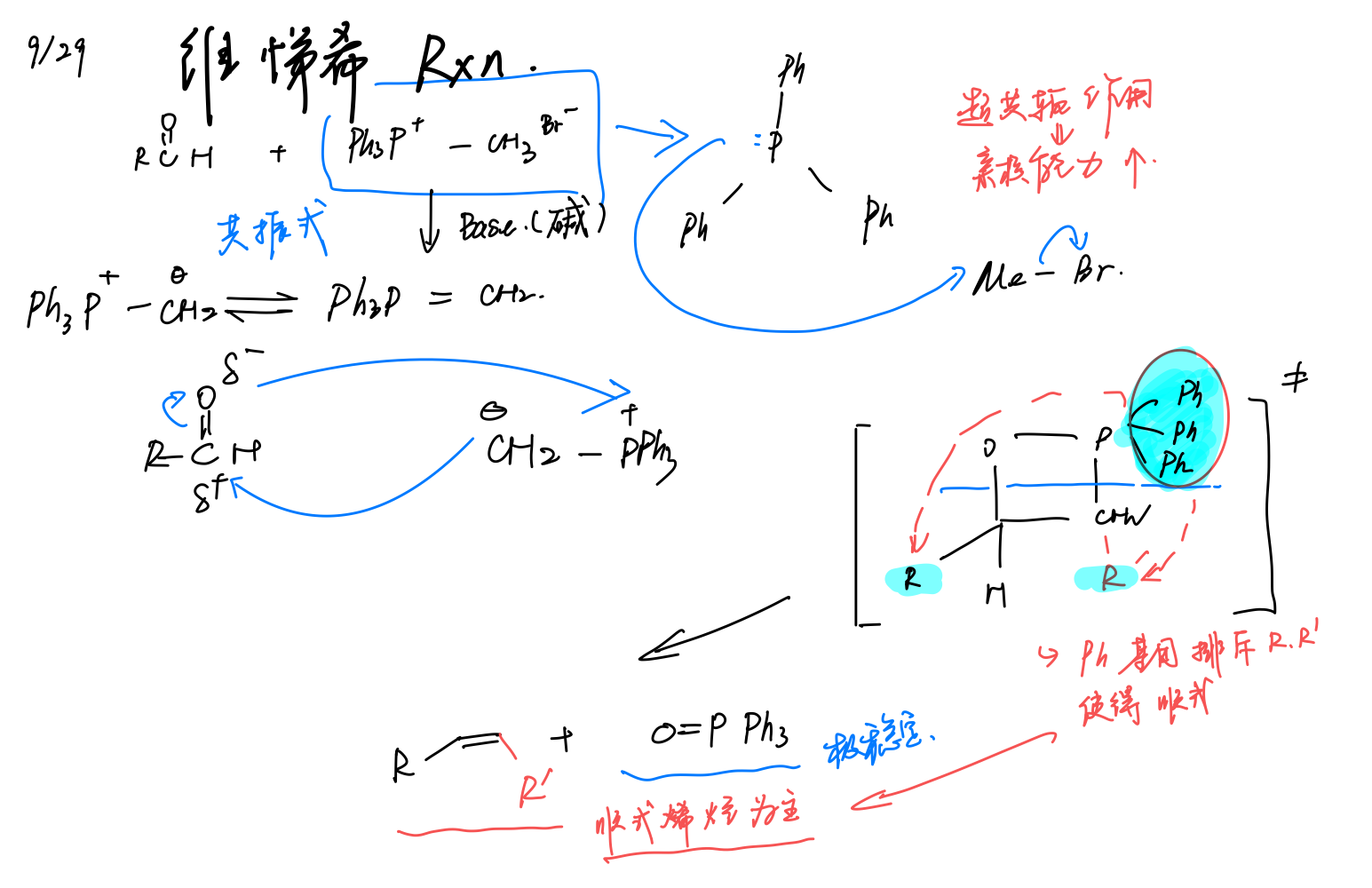
金属有机化合物¶
金属与碳直连的一类有机化合物.
炔烃 共轭烯烃¶
物理性质¶
含碳比例->密度/沸点/熔点高于烯烃