仪器分析笔记¶
Lec1 绪论¶
化学
- 无机
- 有机
- 物化
- 分析化学
- 化学分析
- 仪器分析
- 化学工程
- 高分子化学
分析化学的定义¶
- 研究如何利用物质的物理化学特性对其组成/结构/性质/变化以及反映过程.
化学分析的内容¶
- 计量方法与理论: 称重, 称量, 误差与数据处理
- 滴定: 酸碱滴定, 配位滴定, 氧化还原滴定, 沉淀滴定
- 重量分析: 沉淀, 气化
- 基于颜色/形状的物质分析
仪器分析的研究内容¶
- 定性分析: 化学组成是什么? 结构怎么样?
- 定量分析: 含量有多少?
方法¶
- 中学课本里的几种方法:
- 光
- 点
- 色(谱)
Note
光谱/电化学/色谱/质谱/热分析/力分析/磁分析是仪器分析最常检测的物理参数
电化学方法¶
- 利用: 电子转移 电子交换
- 观测: 电导 电位 电量 电流 阻抗
- 实现: 物质分析
- 方法:
- 循环伏安法
- 基于电位法的
pH计 - 基于电流测量的基因测序
光化学方法¶
- 利用: 电磁波与物质相互作用
- 观测: 电测博的发射 吸收 散射 折射 衍射等变化
- 实现: 物质分析
- 方法:
- 紫外可见光谱(吸收)
- 拉曼散射
- 细胞荧光(光发射)
色谱分析方法¶
-
利用: 混合物中各组分与固定相 流动相分子间的不同作用实现分离的方法
-
方法:
- 色谱分离柱
- 凝胶电泳
仪器分析的特点与学习方法¶
- 涉及基本物理原理, 但关键是认识这些方法而非仪器本身
- 重在理解物质的化学特性与所测物理量之间的关系
- 首要的是理解公式内涵, 而非简单记忆, 背诵和利用公式计算
总结
关键在于理解所测物理量和物质化学特性的关系
分析仪器的基本构建¶
信号发生器->分析信号检测->分析信号处理->分析信号输出
- 信号发生器: 提供能量并从试样中得到被分析成分的分析信号
- 检测器: 接受分析信号并将其转换为易于测量信号的器件(如分光光度法中的光电管)
- 信号处理器: 将检测器得到的信号进行电子及数学处理的器件(放大/衰减/微积分/加减)
- 读出器件: 将处理器输出的信号转变成易于被人读出的器件
仪器分析化学的发展¶
- 向单分子/单颗粒/单细胞与成像科学发展
- 稳态测量->动态 瞬态测量
- 简单分子->生命分子 生命过程
- 新物理原理/方法与材料的引入
X射线分析: DNA双螺旋
激光与纳米结构: 单分子拉曼分析
质谱与蛋白结合: 蛋白质组研究
分析化学的基本术语¶
1. 准确度¶
测量值的总体平均值\bar{x}与"真实值\mu"接近的程度. 是表示测量方法准确程度的标准.
"真实值" == 精度更高的检测值
2. 精密度¶
相对标准偏差(Relative Standard Deviation)
准确度与精密度的区别
- 准确度: 多测测量与真实值之间的差异度
- 经目睹: 多次测量与所得数据的一致(离散)程度
3. 灵敏度¶
反映了仪器或方法识别微小浓度或含量变化的能力.
4. 检出限¶
某一方法可以检出被测物质的最小浓度, 最小质量等信号成为这种方法对该物质的检出限.
Warning
在检出限附近一般不能进行定量分析!
-
它和分析信号与空白信号的波动(噪音, Noise)有关, 或者说与
信噪比(S/N)有关 -
一般规定高于噪音相对标准偏差3倍以上的信号可以认为样品被检出.
灵敏度与检出限的区别与联系
- 灵敏度考察方法对含量变化的敏感程度(斜率)
- 检测限考察检测最低限度(最低点)
- 通常只有方法越灵敏, 检出限才能越低.
5. 线性范围¶
校准曲线的直线部分对应的被测物质的浓度或量的范围.
通常, 好的分析方法应该有较宽的线性范围.
6. 选择性¶
一种检测方法不受干扰的程度被称为选择性, 一般可以用选择系数表示.
分析的优化过程就是消除或减少干扰对测定影响的过程, 也就是提高分析选择性的过程.
绪论总结
- 仪器分析的研究内容
- 仪器分析的特点与学习方法
- 分析化学的基本术语
Lec2 电化学分析¶
电化学分析概论¶
电化学及其发展¶
-
电化学: 研究电能与化学能之间相互转化及转化过程中存在的规律的科学.
-
产生:
-
富兰克林风筝雷电实验
-
伽伐尼蛙腿生物电实验
-
伏打电池
-
电解水->NaOH
-
法拉第电解定律
-
几个要点概念¶
1. 电极¶
-
定义: 联系电子导电相和离子导电相的媒介. 电极的特性是进行不同电化学测量的关键.
电极上的反应: 半反应.
-
金属与溶液接触: 电极电势的形成
-
自发倾向:
-
活泼金属失电子, 溶解倾向越大->金属电位降低(电子留在金属中, 金属离子溶解进溶液中)
-
溶液中的金属离子受金属表面自由电子的吸引, 有结合电子变成中性原子的倾向.->金属电位升高(溶液中的金属离子与金属中的电子结合)
两者"对立统一", 达到平衡.
-
-
平衡的状态与金属性质有关.
-
2. 电极电势¶
电极与溶液间作用形成的电势.是电极-溶液间固有的特性. 如伴有化学反应也是自发反应.
3. 外加电位¶
是通过电池或仪器施加给电极的, "外源性"的电压.能够 迫使 化学反应在电极在电极表面发生.
热力学与电化学的桥梁公式
电化学反应的发生¶
双电层
外加电压时, 电极携带更多或更少的电子并吸引溶液中相反电荷的离子, 从而在界面中形成双电层.(不加电压时也存在)
双电层不超过几个水合离子层厚度(分散层), 因此电场强度很大
电化学反应只在界面上发生
分散层 vs. 扩散层
-
分散层: 双电层视作一个电容器
-
扩散层: 本体和表面的浓度梯度.
电化学分析
通过测量电化学池的电性质对溶液的待测物质进行定性和定量分析.
电化学装置的基本构成: 电化学池¶
-
组成电化学池的条件:
-
至少两支称为电极的导体, 电极之间以导线相连
-
浸在适当的电解质溶液中.
-
发生电子转移
电子自发转移: 原电池
电子被迫转移: 电解池
-
-
原电池的书写:- Zn | ZnSO_4(\alpha_1) | CuSO_4(\alpha_2) | Cu +
-
液接电位: 在两种不同离子的溶或两种不同浓度的溶液的接触界面上, 存在着微小的电位差.
-
产生原因: 不同的离子具有不同的运动速率.(不同的扩散能力)
-
离子的迁移速度随温度/浓度等变化, 难以统一.
离子淌度*
-
-
液接电位的消除: 盐桥
-
饱和KCl溶液: 离子溶度很高, 盐桥和溶液间的接界电势主要由盐桥离子决定.
-
K+与Cl-的迁移或扩散速率相当, 因而液接电位很小, 可忽略.
-
能斯特方程¶
注: 电极电位表示方程, 重要方程
电极电位与温度/ 氧化还原态物质的活度有关
活度: 校准浓度
活度系数: 自学
电极电位影响因素的讨论¶
-
电极电位不仅取决于电极的本性, 还受温度/氧化剂,还原剂/及其介质的活度.
-
298.15K且电子转移为1时, 浓度变化10倍, 电极电位变化约59mV.
-
电极表面氧化还原态\iff电极电位 改变一个, 另一个就相应改变
不同的电极电位¶
-
第一类电极: 金属与该金属离子溶液组成M/M^{n+}
-
第二类电极: 金属-金属难溶盐电极(Ag|AgCl, Cl^-)
AgCl + e \rightleftharpoons Ag + Cl^-
-
第三类电极: 金属与两种具有相同阴离子的难溶盐(稳定配离子)及含有盐的阳离子达到平衡所组成的体系.

- 第零类电极: 惰性电极置于氧化还原溶液中
电极不参与反应, 仅起到传导电子的作用, 但其表面的离子发生反应.
例如:Pt|Fe^{3+}, Fe^{2+}
标准电极电位¶
电极电位是一种势能, 其绝对值无法求得, 常测量其相对值.
-
标准氢电极: 镀铂黑, 活度为1的氢离子, 1标准大气压氢气, 在任何温度下标准氢电极的电位都 规定 为0V.平衡态: 2H^+(aq) + 2e^- \rightleftharpoons H_2(g)
-
测定方法: 标准氢电极(SHE)与给定电极组成原电池(氧化, 还原态活度为1).
-
标准电极电位以还原形式表示, \phi^0越正, 氧化性越强, 越负, 还原性越强.
例子: 原电池的电动势计算

条件电位¶
包含了各种因素对电极电位影响的实际电位.
- 溶液的离子强度, 酸度, 配位反应, 水解反应都会最终影响反应物的活度.
条件电位
氧化态和还原态的浓度等于1mol/L时体系的实际电位.条件电位校准了这些因素对电极电位的影响
生物化学上的条件电位是指在pH=7时的电极电位.
电极种类¶
第零/一/二/三类电极 见 不同的电极电位.
膜电极¶
特点: 具有敏感膜并能产生膜电位, 膜内外被测离子活度的不同而产生电位差.
例: 细胞质中钾离子浓度高, 半透膜只允许K+通过, 膜内外形成膜电势.
微电极¶
特点: 电极区域小, 扩散传质速度快, 电流密度大, 信噪比大, ir小
化学修饰电极¶
对零类电极在电极表面进行分子设计, 将具有优良化学性质的分子, 离子, 聚合物固定在电极表面, 造成某种微结构, 赋予电极某种特定的化学和电化学性质, 提高选择性和灵敏度
电极种类按用途区分

常用参比电极¶
-
氢电极
-
饱和甘汞电极(SCE): 电极电位稳定, 氯化钾浓度不会因为水的挥发而增大.
-
银/氯化银电极
电极-溶液界面的传质过程¶
电极只能直接作用于和电极表面接触的溶液薄层, 而不能直接和本体溶液相作用. 因此要理解电极反应给出的信号的变化, 还必须要考虑物质想表面传递的过程.
-
传质过程类型:
-
对流: 随溶质运动(温差 搅拌)
-
电迁移(电泳): 电场
-
扩散: 因浓度梯度
三种传质类型对电化学信号的影响¶
Cottrell方程: 极限扩散电流¶
前提条件: 电极反应速度极快, 产生的电流完全因传质(扩散)导致[决速步]
法拉第定律¶
在电极上发生电化学反应产生的电流称为法拉第电流
仅因物理作用->非法拉第电流
需要排除非法拉第电流的干扰
本章要点
-
重要概念: 电极电位 条件电位 电动势 工作电极 指示电极 参比电极
-
重要公式: 电极表面的氧化还原过程 溶液中的传质过程
-
重要公式: 能斯特方程 法拉第定律
电子版交老师邮箱
电位分析¶
电位分析法¶
- 基本原理
在通过电极的电流为0的条件下测定电池的电动势或电极电位, 从而利用电极电位与浓度见的关系测定物质浓度的一种分析方法
- 基本公式
离子选择性电极的能斯特表达式
阳离子为正, 阴离子为负
对比: 氧化物在上为正, 还原物在上为负
-
指示电极
-
参比电极
-
分类:
-
直接电位法(pH计)
-
电位滴定法: 利用电极电位的突变代替化学滴定法中指示剂颜色变化来确定终点的滴定分析法.
-
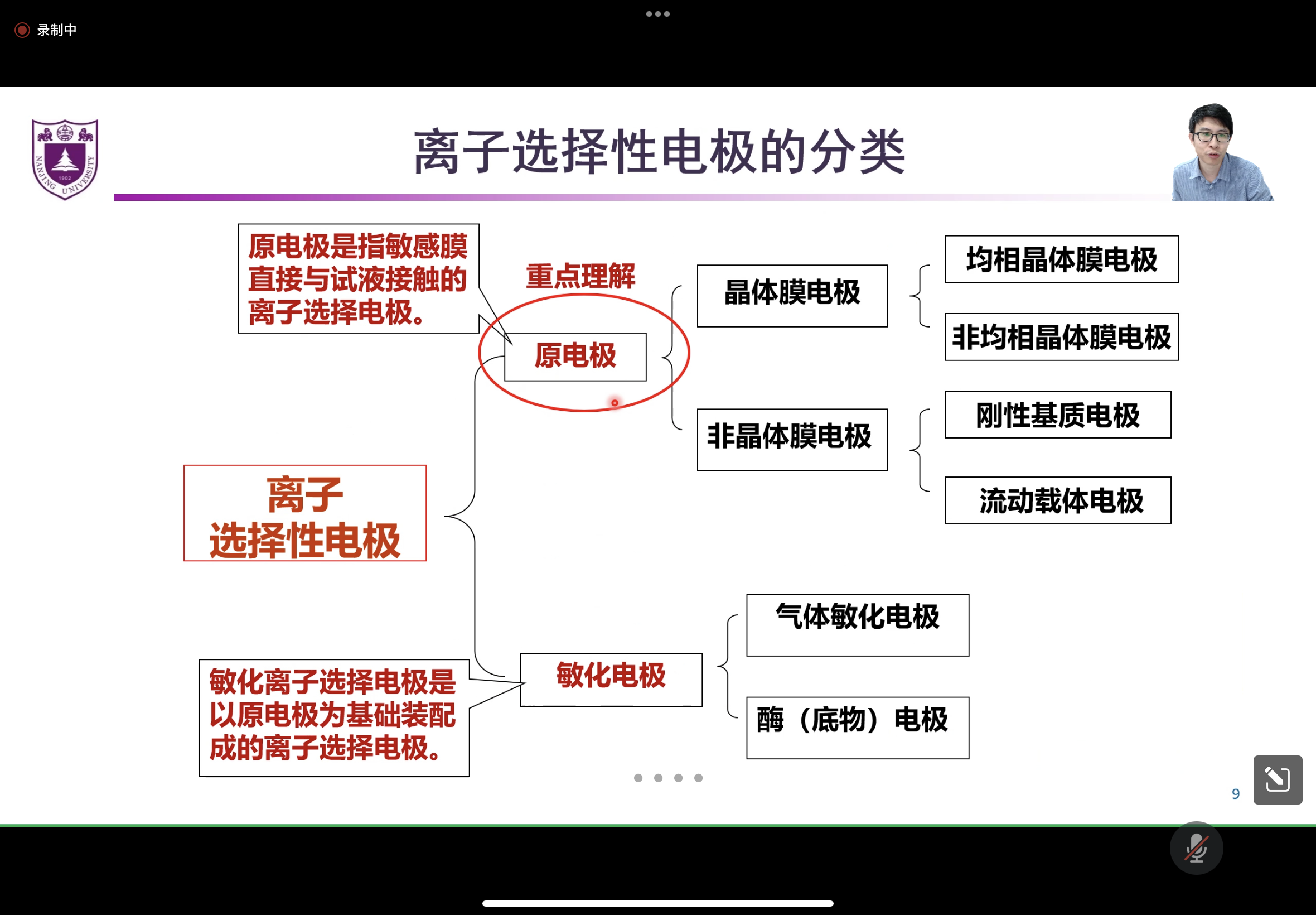
离子选择性电极¶
玻璃电极¶
Ion Selective Electrode, ISE, 是一种膜电极.
敏感膜是指能分开两种电解质溶液并能对某类物质有选择性响应的薄膜, 能形成膜电位.

膜电位总结
-
对H+的高选择性: 膜电位的产生不是电子的得失. 其他离子不能进入晶格产生交换. 当溶液中的na+浓度远高于H+浓度(>1010倍), 两者才产生接近的电位
-
酸差: 测定溶液酸度太大(pH < 1)时, H_3^+为主, 到达电极表面的H+减少, 使得测得的pH值偏高
-
碱差: 或钠差. pH>12 产生误差, 主要是Na+参与相界面上的交换所致. 使测得值偏低.
-
改变玻璃膜的组成, 可制成对其他阳离子响应的玻璃膜电极.
-
优点: 不受溶液中氧化剂,还原剂,颜色及沉淀的影响->不易中毒.
-
缺点: 电极内阻很高, 易碎, 难微小化, 不能在HF中使用.
晶体膜电极¶
分类:
-
含内参比电极 内参比溶液
-
不含~ 直接连导线->要求电极具有强导电性
pH玻璃电极中膜电势形成机制

流动载体电极¶
气敏电极¶
生物电极¶
离子选择电极(ISE)的特性参数¶
-
极差斜率(0.0592/z) -
检测下限: 校准曲线的直线部分与水平延长线的交点对应的活度. -
检出限: 高于噪音水平3倍的信号才能称作信号. 所对应的浓度或绝对量即为检出限
电位选择系数K_{A,B}^{pot}¶
离子选择性电极进行检测时总会受到共存离子的干扰, 即共存离子的存在也会对膜电位有所贡献. 为了表示这种干扰的大小, 引入电位选择系数的概念.
K_{A,B}^{pot} 表示A离子选择性电极抗B离子干扰的能力.
物理意义: 单位活度的干扰离子B^{Z_{B^+}}在ISE上产生的电位相当于多少A^{Z_{A^+}}产生的电位.
显然, K值越小, 表示B离子越不能干扰A离子的检测.
1个B需要几个A来对付, A越少, 说明B越弱.
K_{A,B}^{pot}
-
\ll 1时, 电极受B离子的影响很少, 对A离子的选择性很高.
-
$ = 1$时, 无选择性.
-
> 1时, 对B的选择性好于A.
分析方法¶
电位法¶
标准曲线法¶
TISAB
Total Ionic Strength Adjustment Buffer 总离子强度调节剂
特点: 浓(不受离子试样强度变化影响) 缓冲能力强(不易受试样pH变化影响)
作用:
-
维持样本和标准溶液恒定的离子强度;
-
保持试液在离子选择电极适合的pH范围内, 避免H+或OH-干扰.
-
使被测离子释放称为可检测的游离离子.
标准加入法¶
应用条件:
-
复杂样品, 相似底液很难配制
-
加入的标准样品应该体积小, 浓度高, 不低是不过多改变底液的组成
直读法¶
仪器先用标准溶液校准, 测量被测溶液后直接给出其pH, 本质仍然是校准曲线法.(仪器自己做简单的校准曲线)
gran作图法: 主要处理标准加入和电位滴定数据¶
\phi = k + S\lg c
以10^{\phi / S}对浓度c作图, 原来的对数关系就变成了线性关系.
电位测量精度对测量浓度误差的影响: 误差
离子选择电极的电位与浓度的关系为:
\phi = k + \frac{RT}{zF}\ln\gamma c
微分上式得:
d\phi = \frac{RT}{zF}\cdot \frac{dc}{c}
即: \frac{\Delta c}{c} = \frac{zF}{RT}\Delta \phi = 0.04\Delta \phi (V)
则浓度的相对误差\% = \frac{\Delta}{c}\times 100\% = 4z\Delta \phi \%
本章要点
-
ISE的能斯特方程
-
pH电极传感a_{H^+}的原理, 膜电位形成的原因
-
pH计直读法原理
-
酸差碱差及其原因(结合pH电极膜电位原理)
-
电位选择系数的概念
-
Gran作图的基本概念(X/Y轴)
电重量分析与和库伦分析法¶
区别于
电位分析, 属于电流分析
回顾: 电位分析法¶
膜电势方程
\phi_{ISE} = k + \frac{0.0592}{z_i}\lg a_{i, 外}(阳离子)
\phi_{ISE} = k - \frac{0.0592}{z_i}\lg a_{i, 外}(阴离子)
z_i为离子所带电荷, 由于内侧参比电极往往活度确定, 因此只考虑外侧的离子活度.
-
优势: 检测范围宽
-
劣势: 常量分析准确度不高, 灵敏度差; 不是每种离子都有方便适用的离子选择性电极.
电解分析方法
-
按计量的方式: 库伦分析, 电重量分析
-
电解过程: 控制电位电解(恒电位电解), 控制电流电解(恒电流分析)
电解原理¶
理论分解电压: 使某电解质溶液能够连续发生电解所必须的最小外加电压 E_{分解} = \phi_+ - \phi_-
实际需要的电压往往大于理论分解电压
产生差别的原因: 极化引起的过电位(超电位), 电解回路的下降
过电位产生的原因: 电极极化作用¶
极化: 电流通过电极时, 电极电位偏离可逆电极电位的现象
-
浓差极化: 电极表面待测物浓度小于本体溶液
-
电化学极化: 电极反应迟缓引起(不考虑)
实际分解电压为: V_{分解} = [(\phi_+ \eta_+) - (\phi_- + \eta_-)] ir\\ = 理论分解电压 + 超电压 + 电压降
为什么ISE不引入电极极化?
ISE要求几乎没有电流通过->不形成浓差或者电化学极化现象.
过/超电位的特点¶
过电位/超电位\eta
过电位(英语:overpotential)是电极的电位差值。又叫超电势。为一个电极反应偏离平衡时的电极电位与这个电极反应的平衡电位的差值,无电流通过(平衡状态下)和有电流通过之电位差值。
电压降ir
由于电池/电解池内阻导致额外需要的电压.
一般来说, 金属在铂电极上析出的过电位比较小, 可以忽略; 气体的过电位较大.
电解方式¶
恒定电流电解¶
电压不断增大以维持电流稳定
恒定电压电解¶
电流不断减小(浓度下降)
电解分离法: 阴极电位的选择
依据金属离子析出的电极电位不同, 通过控制电位, 实现分离.
要使金属M_1, M_2完全分离, 电位差需要多大?
完全分离: 金属离子浓度将至原浓度的0.01\%或10^{-6}mol \cdot L^{-1}时
如果要求结束时浓度为原先的0.01%, 电极电位下降4个极差.
因此需要电位差\phi_{M_1} - \phi_{M_2} \ge \frac{0.0592}{z}\times 4
电重量分析¶
电解试液后, 直接称量电极是上析出的被测物质, 从而对其含量进行分析的方法[称质量]
用于检测¶
方法选择:
-
恒电位电解: 电化学选择性好, 速度慢
适合组分较多时
-
恒电流电解: 速度快, 但随着电解进行, 电极电位会发生变化, 可能会导致第二种金属离子在电极上析出产生干扰.
需要除杂.
阳/阴极去极剂: 通过自身的电化学氧化/还原反应, 维持阳极或阴极电位不变. 不在电极上析出沉淀(不影响称重)
用于分离¶
恒电流电解 只能析出电位高于氢的金属, 当金属完全析出后, 将会继续析出氢气
对于电极电势低于H+的金属离子, 可在金属熔融盐中电解得到单质.
库伦分析法¶
通过测量被测物消耗的电量来对被测物含量进行分析的方法.[读取耗电量, 通过法拉第定律求消耗量]
方法选择:
- 恒电流库伦分析法: 常用来产生电生"滴定剂", 利用耗电量来确定物质浓度, 也叫
库伦滴定法
终点指示方法:
-
化学指示剂法
-
电位法
-
永停终点法

库仑滴定 vs. 电位滴定法
电位滴定仍以化学试剂进行滴定, 用ISE取代终点指示剂和目视检测.
库伦滴定是以电极代替化学滴定试剂进行滴定的方法.
进行库伦分析的前提: 电流效应100\% 即电量全部消耗在待测物上.
电流效率 = \dfrac{i_样}{i_样 + i_溶 + i_杂}
影响因素:
-
溶剂的电极反应
-
溶液中杂杂质的反应
-
水中溶解氧
-
电解产物再反应
-
充电电容
本章要点
-
分解电压、超电位、极化作用、去极剂等概念
-
控制电位与控制电流电解特点、理解两种电解中电流或电极电位变化的过程
-
实际分解电压计算
-
两金属完全分离的条件与计算
-
库仑法使用的条件:电流效率100%
-
基于法拉第定律的电重量、库仑法计算
电极化 vs. 过电位
伏安法和极谱分析法¶
回顾
-
电位分析法: 稳态 无电流通过; 困难: 可选择范围窄, 每次测一种离子
-
库伦和电重量分析法: 电解分析 有电流通过电极 存在过电位; 困难: 总量分析, 慢; 只能先电解还原电位高的金属再分析还原电位低的金属; 对不同电介质环境中的还原反应往往难以把握
大参比小电极的目的
-
滴汞电极面积小, 总电流不会很大.
-
参比电极大, 当有电流通过时, 参比电极上电流密度小, 其电极电位保持不变, 外加电压的改变都作用于滴汞电极.
伏安法和极谱分析法都是利用电解过程中得到的工作电极上的电位和电流关系曲线进行分析的方法.
-
伏安法: 才有用固体电极或表面不更新的液体电极, 其面积固定.
-
极谱法: 采用表面周期性更新的滴汞电极.
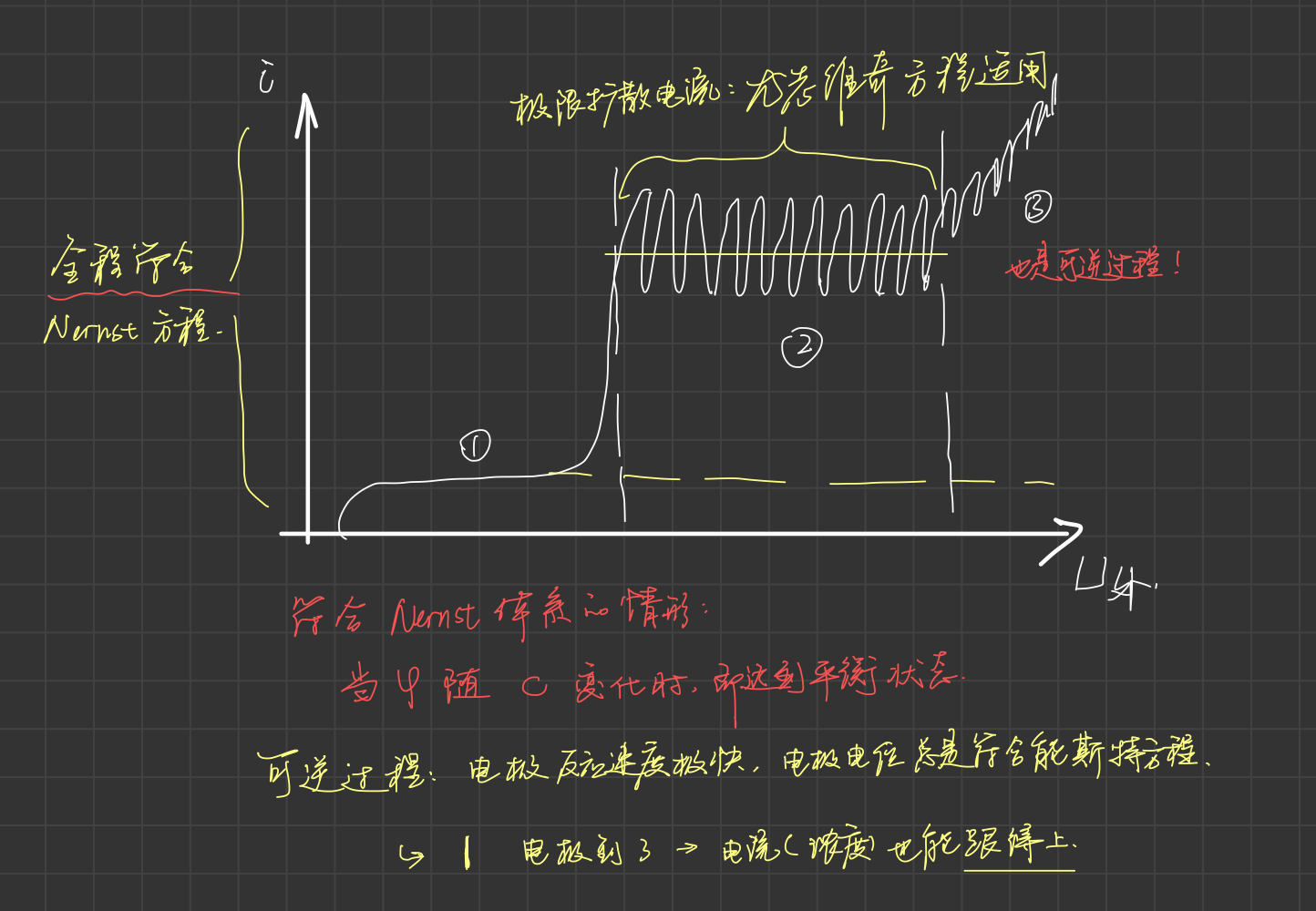
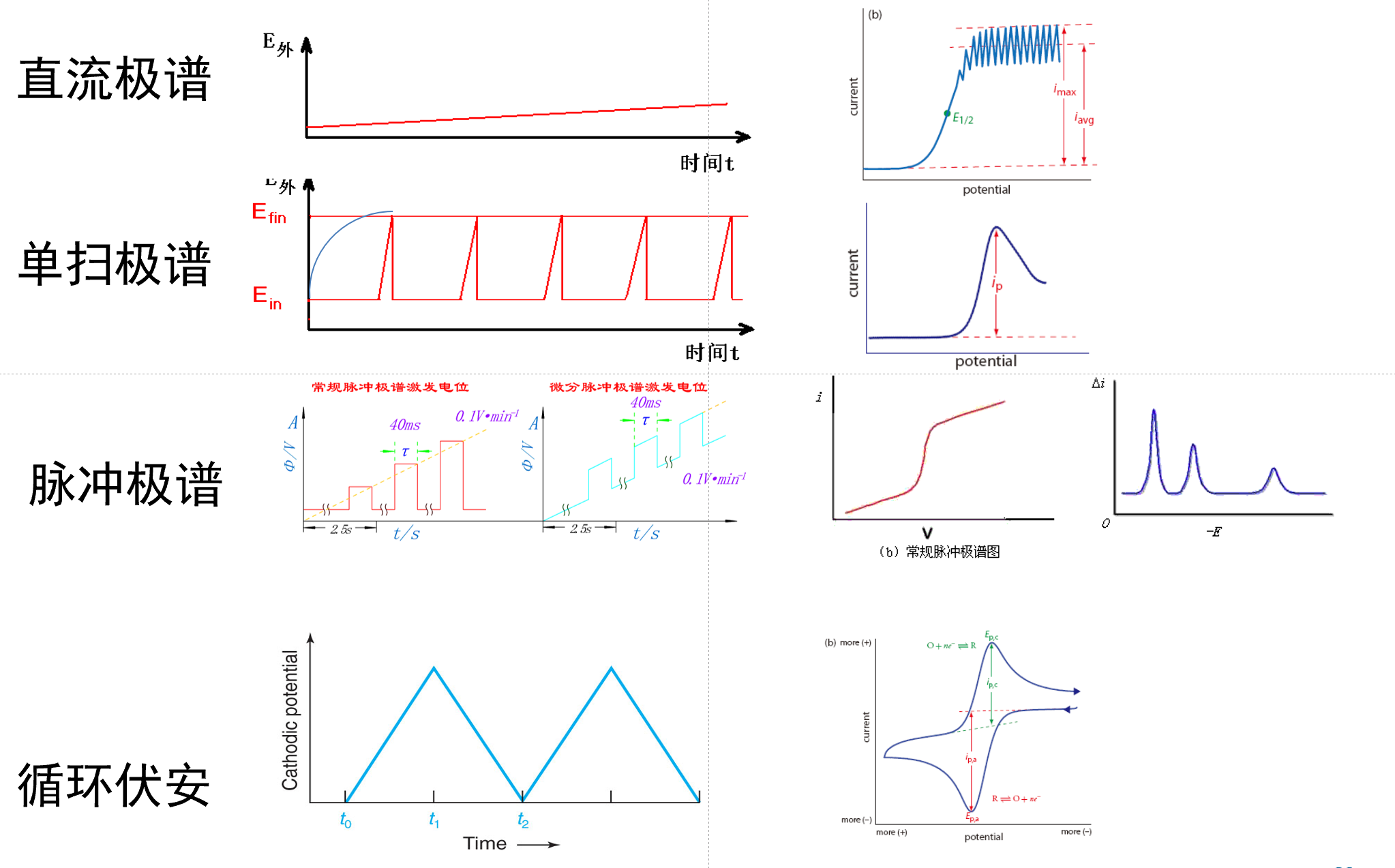
直流极谱法¶
采用滴汞电极为工作电极, 缓慢改变电极电位, 同时测量电流绘制i-V曲线.
- 锯齿状极谱波的形成
滴汞电极生长过程中, 电极面积增大, 扩散层厚度增大;
电流初期增长较大, 随后变缓;
汞滴落下时, 电极面积急速下降, 电流急速下降, 形成锯齿波.
-
残余电流
-
来源
-
溶液中微量的杂质金属离子还原
-
滴汞电极的充放电
-
微量氧气的还原
-
-
-
电流的迅速升高: 去极剂(镉)稳定电位
-
极限扩散区: 滴汞表面镉浓度因为快速消耗趋近于0, 电极表面形成稳定的扩散层, 反应受浓度扩散控制, 此时电流值最大, 称为
极限电流.
半波电位\varphi_{1/2}
扩散电流值的一半对应的电位. 此时氧化物比还原物的浓度为0, 此时电位即标准电极电位. 因此\varphi_{1/2}为定值, 和被测物浓度无关.
极谱分析法是一种好的定量分析方法, 但用于定性分析并不可靠, 形成络合物会影响\varphi_{1/2}, 此外, 很多金属\varphi_{1/2}接近导致混合物中难以测量.
利用极限扩散电流定量的依据
无对流和电迁移条件下 , 达到极限扩散电流时, 电流与物质的扩散速度成正比, 扩散速度与扩散层中浓度梯度成正比.
结论: 扩散电流与离子浓度成正比.

尤考维奇方程¶

contrell方程 vs. 尤考维奇方程
尤考维奇方程引入了电极面积的变化.
影响扩散电流的因素¶
-
毛细管常数: 607zD^{½}
-
扩散电流常数: m^{2/3}t^{1/6}
-
温度: 影响除z外的每一项
提高可重复性, 前提是常数一致.
干扰电流及其消除¶
- 对流电流和迁移电流
测量时通常加入大量支持电解质, 以消除迁移电流和降低溶液电压降(IR降).
- 氧气还原
产生两次还原反应
除氧方法: 1.加亚硫酸钠(碱性或中性溶液); 抗坏血酸(弱酸性); 碳酸钠或Fe粉(强酸性)
2.通入惰性气体, N_2, Ar, H_2
- 极大(现象)
随着外加电压变化, 极谱波的前部出底线电流极大值, 称为极谱极大.
产生原因: 汞滴表面电荷分布或物质密度不均匀->表面张力不均匀->汞滴切向运动->相当于更新出新的反应界面
消除方法: 加少量的表面活性物质/动物胶(使得表面粘稠程度, 降低切向运动程度)==>"极大抑制剂"
-
残余电流
-
杂质的电解: 纯化试剂/预电解
-
充电电流: 充电电流来源于滴汞电极与溶液界面上双电层的充电过程. ==>消除办法: 在汞滴末期记录电解电流
-
-
叠波: 两种组分的半波电流过于接近==>改变一种组分的形式
区分界限: 200mV
前波: 两种组分的极限电流i_B, i_A, i_B \gg i_A, 导致后者的极限电流被前者掩盖==>掩蔽前者的电流.
氢波: 酸性溶液中, H^+在-1.2~-1.4V在滴汞电极上产生还原波==>在中性或者碱性溶液中测定.
极谱波方程¶
描述极谱电流与滴汞电极电位间关系的数学表达式称为极谱波方程.
可逆还原过程极谱波方程

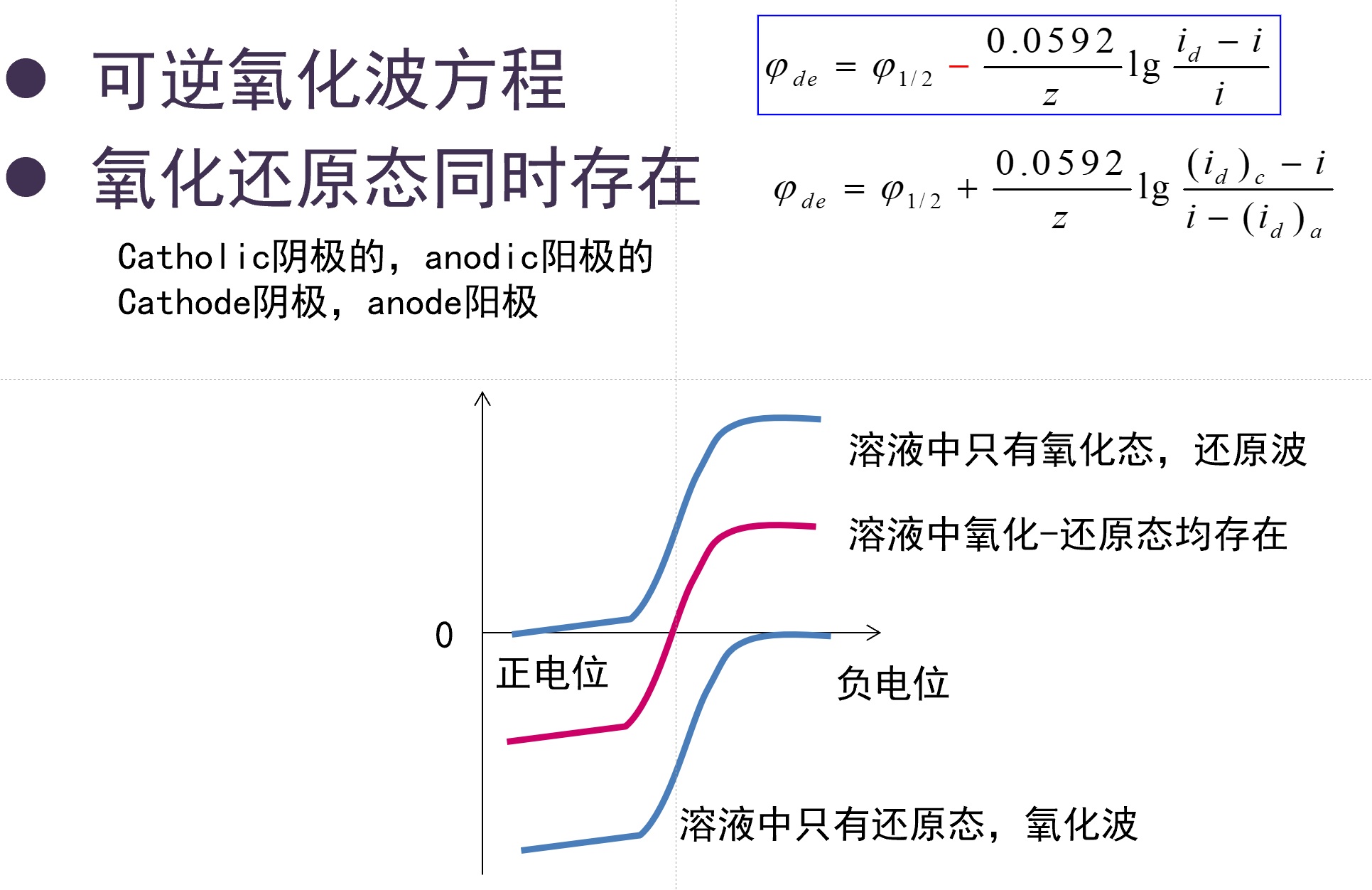
不可逆极谱波¶
物质在电极上的反应速度比较慢, 不能立刻满足能斯特方程, 即: 不能立刻在电极表面形成该电位下应有的物质氧化还原态活度比.
-
特点: 波形倾斜小于可逆极谱波, 电位更高时, 电极反应速度仍然可以加快, 变为扩散控制的电极过程.
-
用途: 通过加快电极扫描速度, 使得极谱波变成不可逆波, 从而测量物质反应产生的电流速度.
极谱波高的确定¶
经典直流极谱的缺点
-
速度慢
-
方法灵敏度较低: 检测下限10^{-4} \sim 10^{-5}\mathrm{mol/L}, 这主要是受干扰电流的影响.
-
分辨率差: 台阶状波形不易区分重叠波
-
ir降大
三电极系统¶
利用运算放大器使通过参比的电流都从对电极流过, 利用普通参比电极和对电极代替经典极谱中的大面积甘汞电极, 对电极也叫辅助电极.
-
特点:
-
参比电极体积小
-
几乎不流过
-
单扫电极¶
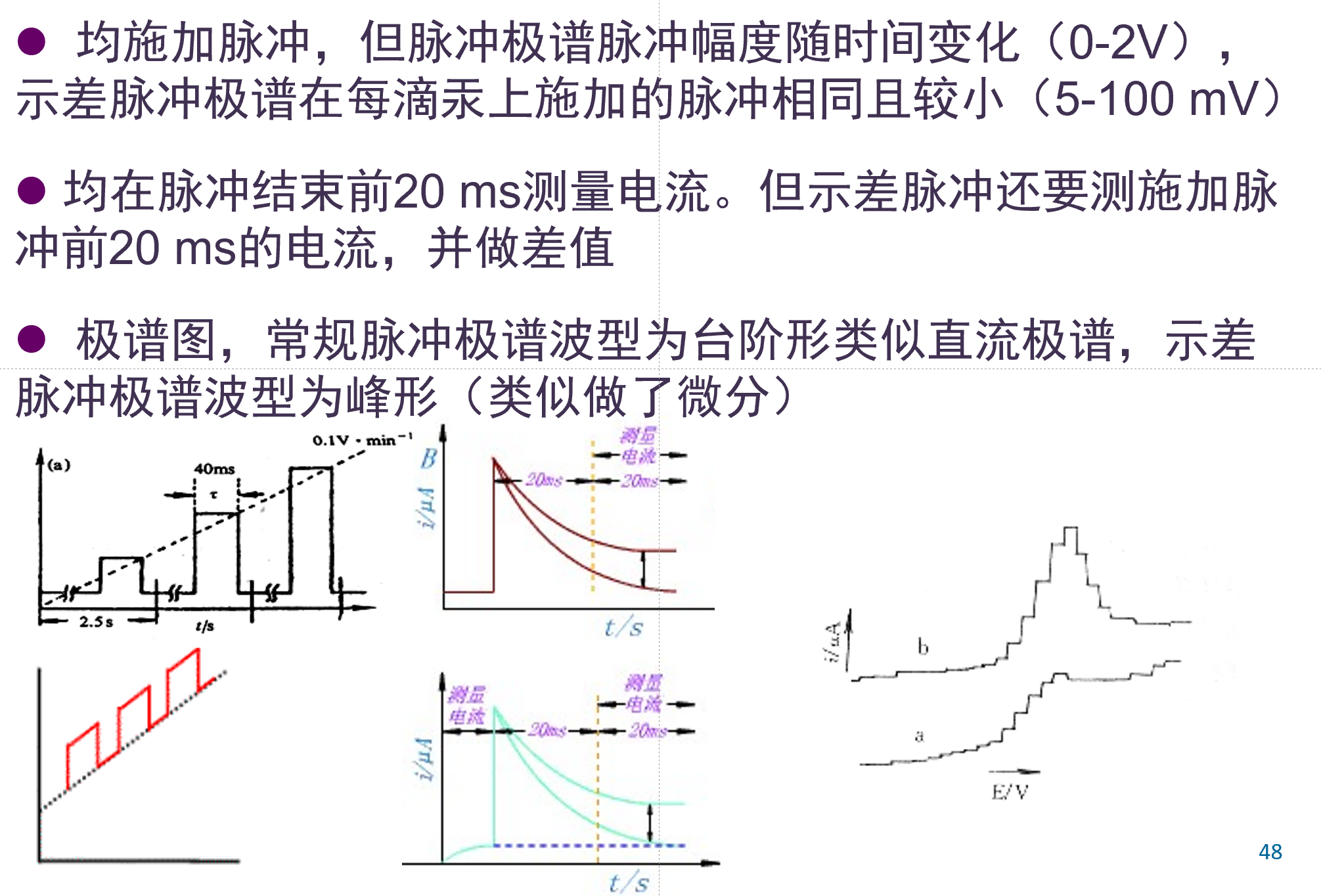
脉冲极谱法¶
-
目的: 降低充电电流.
-
汞末期施加矩形脉冲, 加脉冲20ms后测量电流
汞末期电极面积比较稳定, 可以使用contrell方程.
在20ms后测量电流, 此时充电电流几乎为0, 测量的只剩电解电流.
示差脉冲电极极谱波¶
脉冲极谱与示差脉冲极谱波异同
溶出伏安法¶
先将金属离子还原成金属
然后再氧化, 通过库伦分析法测量电量.
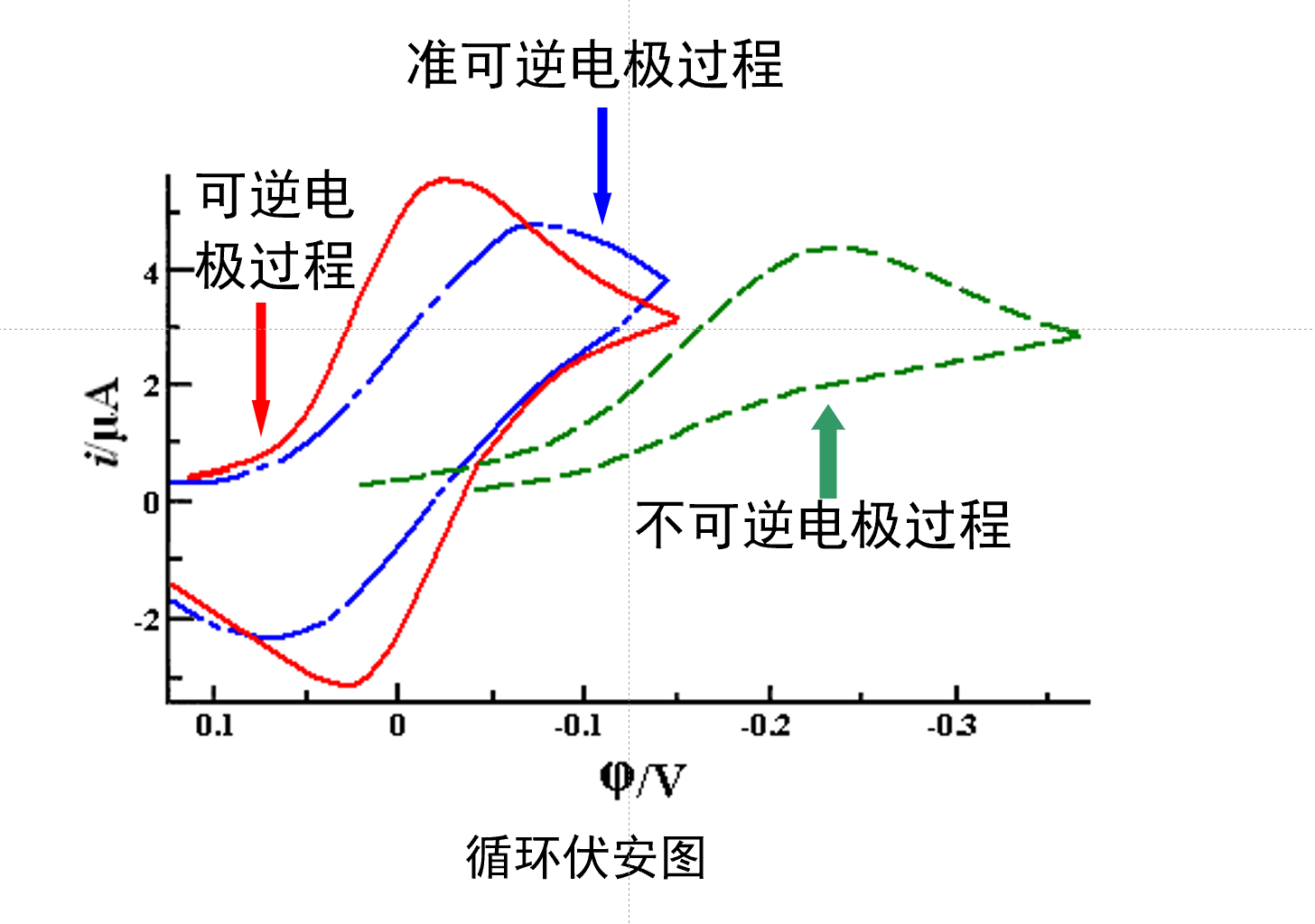
循环伏安法¶
先扫一遍还原极谱, 再扫一遍氧化极谱.
作用:
- 电极过程可逆性判断.
几种电位扫描和极谱曲线的比较
Lec3 色谱与电泳¶
色谱法chromatography¶
绪论¶
-
色谱法: 一种分离分析方法. 利用各物质在两相中具有不同的分配系数, 当两相作相对运动时, 这些物质在两相中进行多次反复的分配来达到分离目的. -
固定相: 色谱中固定不动的相, 可以是固体, 液体. -
流动相
色谱法(碳酸钙+石油醚)→分配色谱→气相色谱与塔板理论→液相色谱仪→使用高压泵的高效液相色谱.
色谱法分类
-
按流动相状态:
-
气相色谱: 流动相为气体.
-
液相色谱
-
超临界流体色谱法
-
流动相为气相/液相分别适合分析哪些物质?
- 液相: 可分析液体/ 可以溶解在液体中 的离子.
-
按固定相状态:
-
气相色谱, 包含: 气-固色谱, 气-液色谱
-
液相色谱, 包含: 液-固色谱, 液-液色谱
-
-
按分配原理:
-
吸附色谱: 吸附与解吸附能力
-
分配色谱: 溶解度大小
-
-
按固定相的形式分类:
-
固定相在柱内, 称为
柱色谱: 填充柱色谱, 开管柱色谱 -
固定相呈平板状, 称为
平板色谱: 纸色谱, 薄层色谱
-
-
按固定材料:
-
离子交换色谱: 固定相为离子交换剂(分离离子)
-
尺寸排阻色谱: 固定相为多孔高聚合物.
-
化学键合色谱: 固定液与多孔载体通过化学键组合成固定相.
-
色谱的仪器化和色谱曲线¶
常规柱/平板色谱: 肉眼观察的限制: 只能看见可见光, 分辨率低, 检出限低.
常见的仪器定量分析方法:
- 紫外检测
- 原子吸收检测
- 电导检测
- 热导检测
- 质谱检测
色谱流出曲线: 信号强度与记录时间的关系图. 只有仪器化后, 才能进行准确的分析.
色谱法的术语¶
-
基线: 无样品流过检测器时的信号-时间曲线
-
死时间: 非滞留组分(如气相色谱中的空气)从进样到色谱峰顶所对应的时间t_0
死时间可以推出流动相的流动速度.
-
保留时间: 某组分从进样到色谱峰顶所需的时间t_R
-
调整保留时间: 扣除死时间后的保留时间t_R' = t_R - t_0, 代表纯粹的分配时间.
-
峰高: 峰顶到基线垂直距离h
-
半峰宽: 色谱峰一半处的峰宽W_{1/2}
-
峰底宽: 色谱流出曲线两侧拐点所做的切线与基线交点间的距离W_b
-
峰面积
-
标准偏差\sigma: 正态分布曲线两侧拐点间距离的一半, 是峰底宽的\dfrac{1}{4}
标准偏差\sigma
研究\sigma的意义: 标准偏差和置信度
一般要求: 将置信区间控制在95%以上
由色谱流出曲线可以实现以下目的:
-
色谱峰的数目->判断试样中所含组分的最小个数.
-
根据色谱峰的保留值进行定性分析
-
依据峰高和峰面积进行定量分析
-
评价分离效能
色谱分析基本原理¶
分配过程
- 分配系数K: 假设考虑分离柱的一小段, 组分在固定相和流动相间分配达到平衡时组分在两相间的浓度之比为一常数, 称为分配系数:
m: mobile phase 流动相
s: stationary phase 固定相
\Delta_r G_m通常为负值, 因此提高温度->K增大.
讨论
-
K是组分与固定相/流动相结合能差异的参数
-
一定温度下, 组分的K越大->出峰越慢
-
两种组分K值之比越大, 则分离效果越好
-
同一个组分在不同的固定相上的分配系数K不同
-
选择适宜的固定相/流动相可以改善分离效果
-
某组分K = 0时, 即不被固定相保留, 最先流出
分配比: 分配达到平衡时组分在两相中的总量之比, 可以是重量/体积/或物质的量之比, 又称容量因子.
\beta为色谱柱的流动相-固定相体积比值.
保留值
记F_c为流动相体积流速,则V'_R = V_R - V_m = (t_R - t_0) \cdot F_c称为调整保留体积, 体现组分在柱内的绝对滞留情况. 其中, 记V_m = t_0 \cdot F_c为死体积.
线速度
组分的线速度: r = \dfrac{L}{t_R}
流动相的线速度: u = \dfrac{L}{t_0}
r与u的关系: r = uf_m, f_m为组分在流动相中的总量占其色谱柱中总量的百分比.
举例: 若k' = 1, 则f_m = \dfrac{1}{1+1} = 0.5, r = 0.5u
f_m = \dfrac{1}{1+k'}
k' = \dfrac{t'_R}{t_0}
物理含义: 在认为组纷纷在固定相/流动相之间的分配能即刻完成的情况下, 分配比可以直接通过流出曲线上的死时间和保留时间得到.
基本保留方程

相对保留值
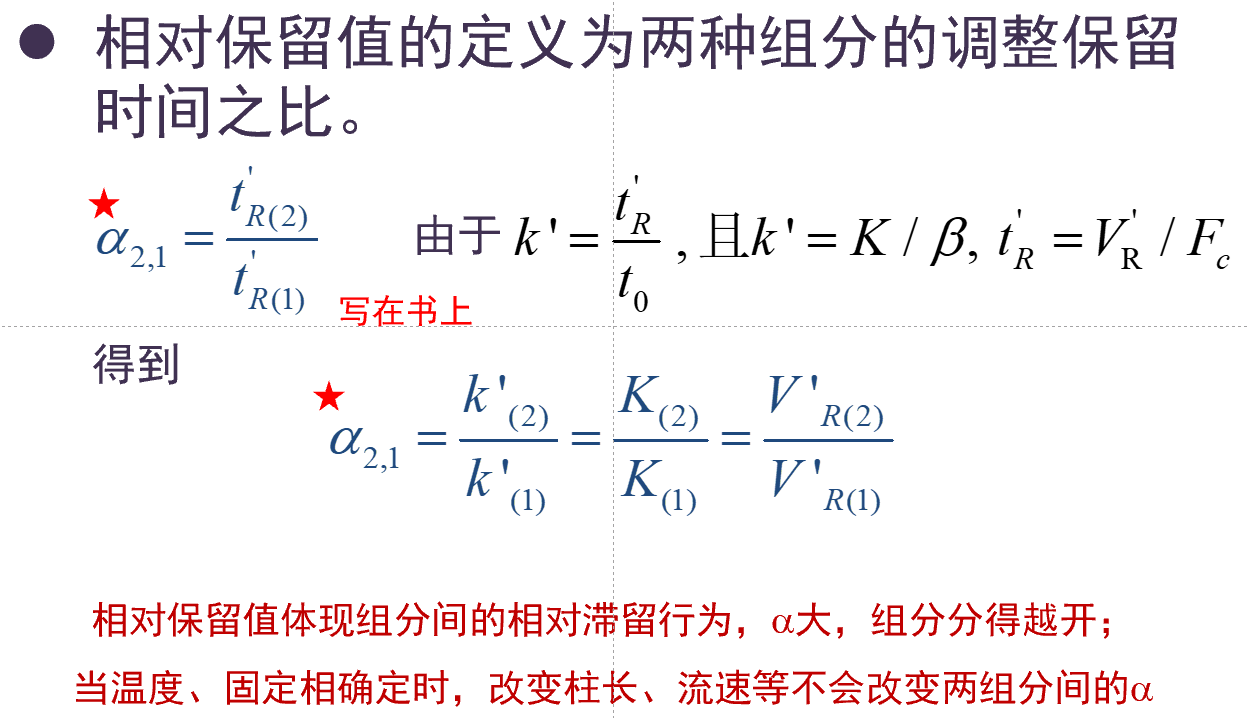
V_m, V_s, V_R, V_{R'}
-
V_m = t_0 \cdot F_c为死体积, F_c为流动相体积流速.
-
V_s为固定相体积, 一般题目给出或者通过\beta = \dfrac{V_m}{V_s}得到
-
V_R = t_R \cdot F_c = (1+k')t_0\cdot F_c为保留体积
-
V_{R'} = t_R' \cdot F_c = (t_R - t_0)\cdot F_c为调整保留体积
塔板理论和速率理论¶
塔板理论 plate theory: 柱分离效能指标¶
微观来看,为什么一个个组分被分开并且呈正态分布?
将色谱分离过程比拟作蒸馏过程,将连续的色谱分离过程类比为多个非连续的塔板上的多次的平衡过程的重复;在每一个塔板上,被分离组分达到一次分配平衡。
假定
-
塔板间不连续(固定相划分为一个个微分单元)
-
塔板间无分子扩散(不考虑纵向扩散)
-
组分在塔板两相间 瞬时 达到分配平衡(动力学迅速, 达到一次分配平衡所需的最小柱长为理论塔板高度)
-
组分在每一塔板上的分配系数相同.
-
流动相以一个个塔板体积加入(划分为一个个微分单元)

速率理论: 动力学理论¶
考虑4种影响: 涡流, 纵向分子扩散, 流动相传质, 固定相传质
1. 涡流\sigma_e^2, e = eddy

2. 纵向扩散\sigma_l^2, l = axial

3. 流动相传质阻力\sigma_m^2
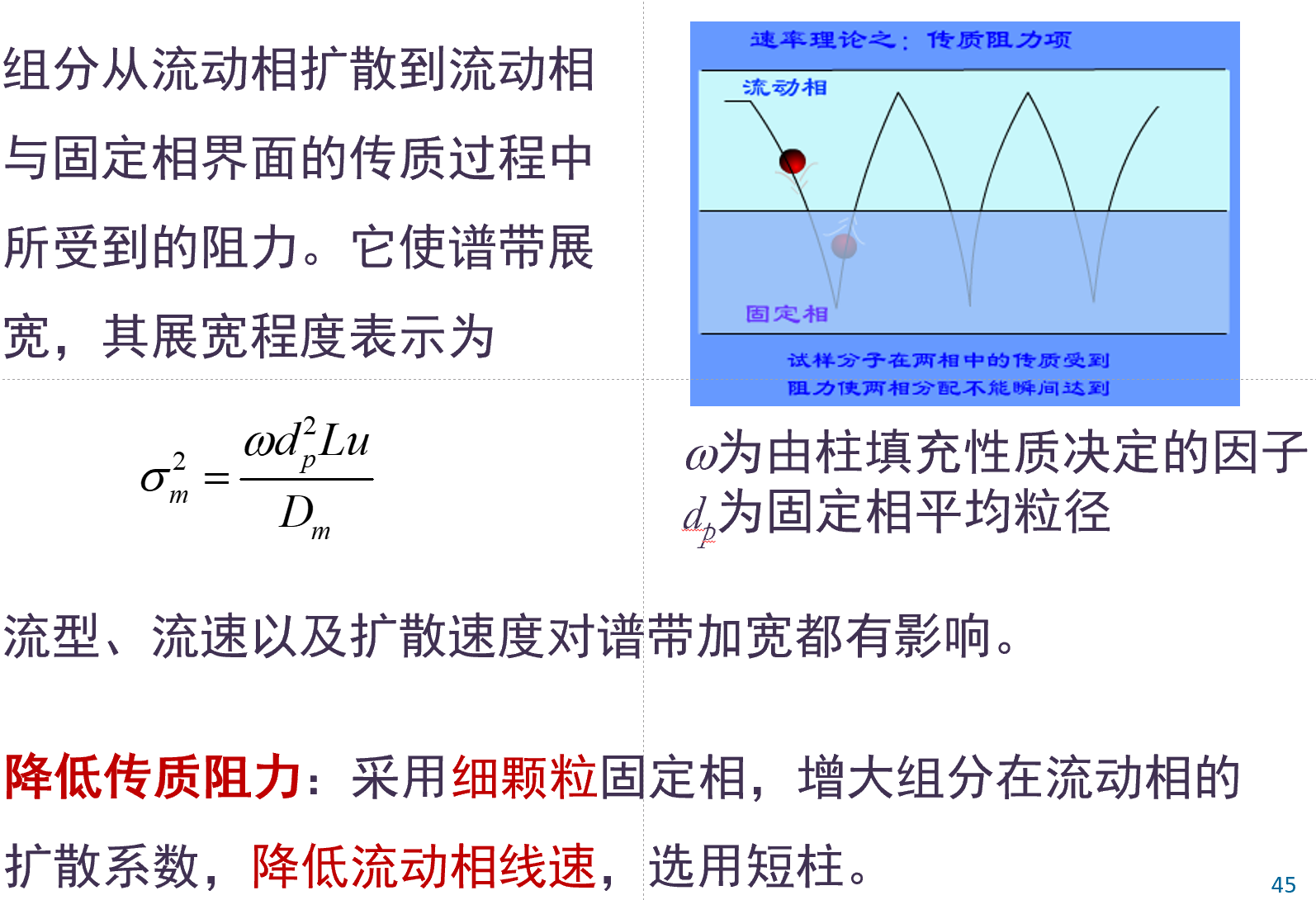
4. 固定相传质阻力

流速理论方程---Van Deemter Equation


分离度¶
分离度:是用来表示两峰实际分离程度的参数。 用Rs表示(Resolution of separation)


讨论

气相色谱法 Gas Chromatography¶
组成:
-
载气系统(carrier gas system)
-
进样系统(sample injection system)
-
色谱柱系统(column system)
-
检测系统(detection system)
-
数据系统(data system)
载气系统¶
-
分子量小, 热导系数大, 粘度小
-
常用于热导检测器
-
扩散系数小, 柱效比较高
-
除热导检测器外的其他几种检测器, 多采用氮气作为载气.
-
要求: 纯度在99.99%以上, 净化
-
载气选择: 主要取决于检测器, 色谱柱及分析要求.
进样系统¶
目标是使样品进入分离柱前 瞬间气化 .
分流口: 由于气化引起的体积急剧膨胀, 样品量过大, 可能造成损坏, 因此需要分流口排气, 平衡柱压, 缺点是 使得进样量难以准确控制 (一般只有1-5%进入分离柱).
色谱柱系统¶
主要包含填充柱和开管柱.
-
填充柱:
- 内径2~4mm, 长度1~10m, 柱形多为螺旋形, 为减少
跑道效应(非直线跑道存在内侧路径长度更短), 其螺旋直径与柱内径之比要大一些(15:1 ~ 25:1)
- 内径2~4mm, 长度1~10m, 柱形多为螺旋形, 为减少
-
开管柱:
-
柱内不转填料, 空心柱->阻力小
-
内径0.1-0.2mm, 长度可达百米.
-
温控系统¶
用于设定, 控制, 测量气化室, 柱室, 检测室三处的温度.
气化室温度应使试样瞬间气化而又不分解
柱室: 恒温/程序升温
程序升温
举例: 当部分组分的沸点低且密集, 部分组分的沸点高且分散时, 如果使用恒温, 会使得沸点低的部分过于幂集, 沸点高的部分过于稀疏, 通过降低前期温度, 提升后期温度, 使得分离的时机分散均匀.
检测系统¶
载气中通过的检测器组分浓度瞬间的变化.->热导检测器, 电子捕获检测器
测量信号值与单位时间内进入检测器组分的质量成正比.->火焰离子化检测器, 火焰光度检测器.
对所有的物质有相应, 热导检测器器
电子捕获检测器
检测器性能指标¶
-
灵敏度S = \dfrac{\Delta R}{\Delta m}
-
检测限D = \dfrac{2R_N}{S}: 定义为两倍噪音时对应的被测物质量, 不经过色谱柱, 直接进入检测器
-
最小检测量m_{min} = 1.065W_{1/2}D: 组分经过色谱柱的量
热导检测器TCD¶
- 测定原理: 利用组分与载气之间的热导率之差.
氢火焰离子化检测器FID¶
等离子体
第四态: 物质所含部分电子在能量的作用下脱离原子核的吸引, 呈现出自由电子和带电离子分离而又共存的一种状态.
-
估计宇宙中99%以上的物质以等离子体状态存在
-
常见的等离子体: 太阳, 火焰, 闪电, 极光, 霓虹灯
有机物在氢氧焰中燃烧产生正负离子和电子(等离子体), 在电场作用下电子被手机极捕获, 正离子被发射极捕获.
电子捕获检测器ECD¶
-
高选择性检测器, 只对电负性高的物质有响应.
-
较多应用于农副产品, 食品及环境中农药残留量的鉴定.
火焰光度检测器FPD¶
对S, P有高响应值的选择性检测器
S,P在燃烧过程中发射出394nm, 526nm的特征光, 从而进行特征性检测.
其他检测器¶
-
热离子检测器
-
联用仪器: 气相色谱与质谱相连.
填充柱气相色谱¶
载体
固定液的支持骨架, 固定液可以在其表面形成一层薄而均匀的液膜.
特点:
-
多孔, 比表面积大
-
化学惰性, 表面没有活性, 但有较好的浸润性.
-
热稳定性好
-
无催化作用
-
有一定的机械强度
-
颗粒大小均匀, 适度. 一般采用60~80目, 80~100目
大致分为: 硅藻土类和非硅藻土类.
硅藻土
硅藻化石通过机械加工(如煅烧), 得到两种不同的材料:
-
红色硅藻土: 孔径小(~2\mu m), 表孔密集, 比表面积大, 机械强度好. 常与非极性固定液配伍, 适宜分离非极性或弱极性组分的试样, 缺点是表面存有活性吸附中心点, 有一定的催化活性.
-
白色硅藻土: 煅烧前原料中加入碳酸钠, 颗粒疏松, 孔径较大, 比表面积较小, 机械强度较差, 但吸附性显著减小(不容易形成催化活性位点), 常与极性固定液配伍, 分离极性试样.
固定液要求:
-
热稳定性好
-
化学稳定性好
-
固定液的粘度和凝固点要低
-
各组分在固定液中均有一定的溶解度
组分与固定液分子间的作用力
-
定向力(静电力): 由极性分子的永久偶极间的互相吸引产生(强)
-
诱导力: 极性分子和非极性分子之间的相互作用力(较弱)
-
色散力: 非极性分子由分子形变产生一定的极性, 因为非极性分子之间也可能存在吸引力(较强)
-
氢键力: 含有电负性较强的原子与氢原子之间的作用力.
体现出一定的"相似相溶"性质.
固定液特征常数:
- Kovats保留指数I_x: 人为定义碳数为n的正构烷烃(一条碳链), 保留指数为100n, 用保留时间紧邻待测组分的两个正构烷烃来标定组分的相对保留值. 通过保留时间来计算比例.
- 麦氏常数
利用苯, 丁醇, 2-戊酮, 硝基丙烷, 吡啶等物种代表不同类型作用力的物质在被测固定液与角鲨烷柱上保留指数的差值, 分别以x', y', z', u', s'表示.
计算上述五个指标, 计算平均值, 可以作为参考值.
为什么以角鲨烷为参考?
角鲨烷为典型的非极性固定液, 多数固定液和角鲨烷比较, 能够得到正值.
固定液的选择: 相似性原则

决定流出顺序的力:
-
组分的相对挥发度的大小(沸点)
-
组分分子与固定液分子之间的作用力的大小.
手性选择剂¶
常见拆分方法: 直接结晶法, 酶拆分法, 化学拆分, 色谱分离(主要)
气-固色谱中的固体吸附剂¶
-
种类
-
活性炭
-
活性氧化铝
-
硅胶
-
分子筛
-
高分子多孔微球
开管柱气相色谱法¶
分类¶
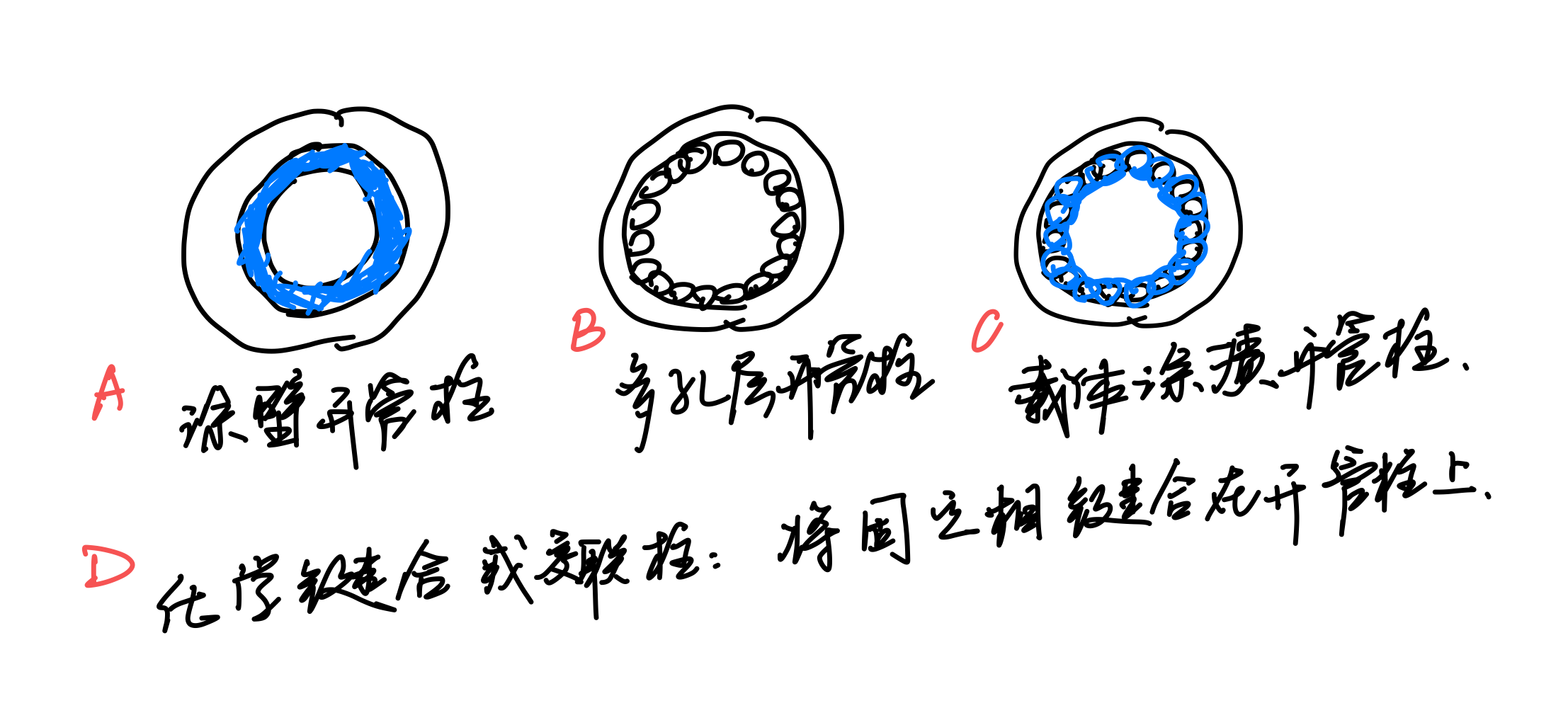
定量分析¶
峰面积的测量:
- 用三角形面积进行估计: A= 1.065W\cdot h
定量矫正因子¶
-
绝对矫正因子f_i = m_i / A
-
相对矫正因子f_i' = \dfrac{f_i}{f_s} = {m_i\over m_s}\cdot {A_s\over A_i}
常用的几种定量方法
内标法 : 只需内标物及预测组分出峰, 操作条件变化而引起的误差小.
缺点: 内标物选择困难.
归一化法 :
c_i = \dfrac{m_i}{\sum m_i}\times 100 = \dfrac{f_i'\cdot A_i}{\sum (f_i'\cdot A_i)}\times 100 \approx \dfrac{A_i}{\sum A_i}\times 100
矫正因此相等时, 可以直接用峰面积, 不用加标准物.
要求所有组分均出峰.
校准曲线法 : 不是很准确, 少用. 液相色谱中可以使用.
为什么气相色谱只用来做定性/定量分析, 而不做分离?
因为大量的气体通过分离口流出, 分离效率低.
高效液相色谱法及超临界流体色谱法¶
review
液相色谱: 以液体为流动相的色谱方法.
-
经典液相色谱: 固定相颗粒大, 性质单一, 人为分辨条带
-
高效液相色谱: 颗粒细而规则, 孔浅, 高压输液, 高灵敏检测器
与气相对比:
-
气相的流动相为惰性气体
-
液相的流动相也与组分发生作用
概论¶
固定相¶
分类:
以承受高压的能力, 分为 刚性固体 和 硬胶
-
刚性固体以二氧化硅为基质, 可承受7.0\times 10^8 \sim 1.0\times 10^9Pa的高压, 目前最广泛的一种固定相, 一般不用于pH大于8的体系.
-
硬胶可承受3.5e8的压力, pH8\sim 12
以孔隙深度分为: 表面多孔型 和 全多孔型
-
表面多孔型: 死体积小, 传质阻力小, 出峰快
-
全多孔型: 出峰快, 组压高
-
[ex]整体柱
流动相¶
-
纯度高: 固体颗粒和杂质会堵塞通道, 引起基线不稳, 或产生"伪峰". >
化学纯->分析纯->色谱纯 -
粘度适中: 过高, 柱压高, 不利于分离; 过低, 容易形成气泡, 影响分离
-
化学稳定性好, 沸点要高于55^oC, 低沸点容易形成气泡.
-
极性适中, 溶解性好, 选择性好
-
溶剂与检测器匹配
-
紫外吸收检测器: 溶剂在检测器响应范围内无吸收
-
折光率检测器: 溶剂与组分的折光率差别大
-
高效液相色谱仪¶
组成¶
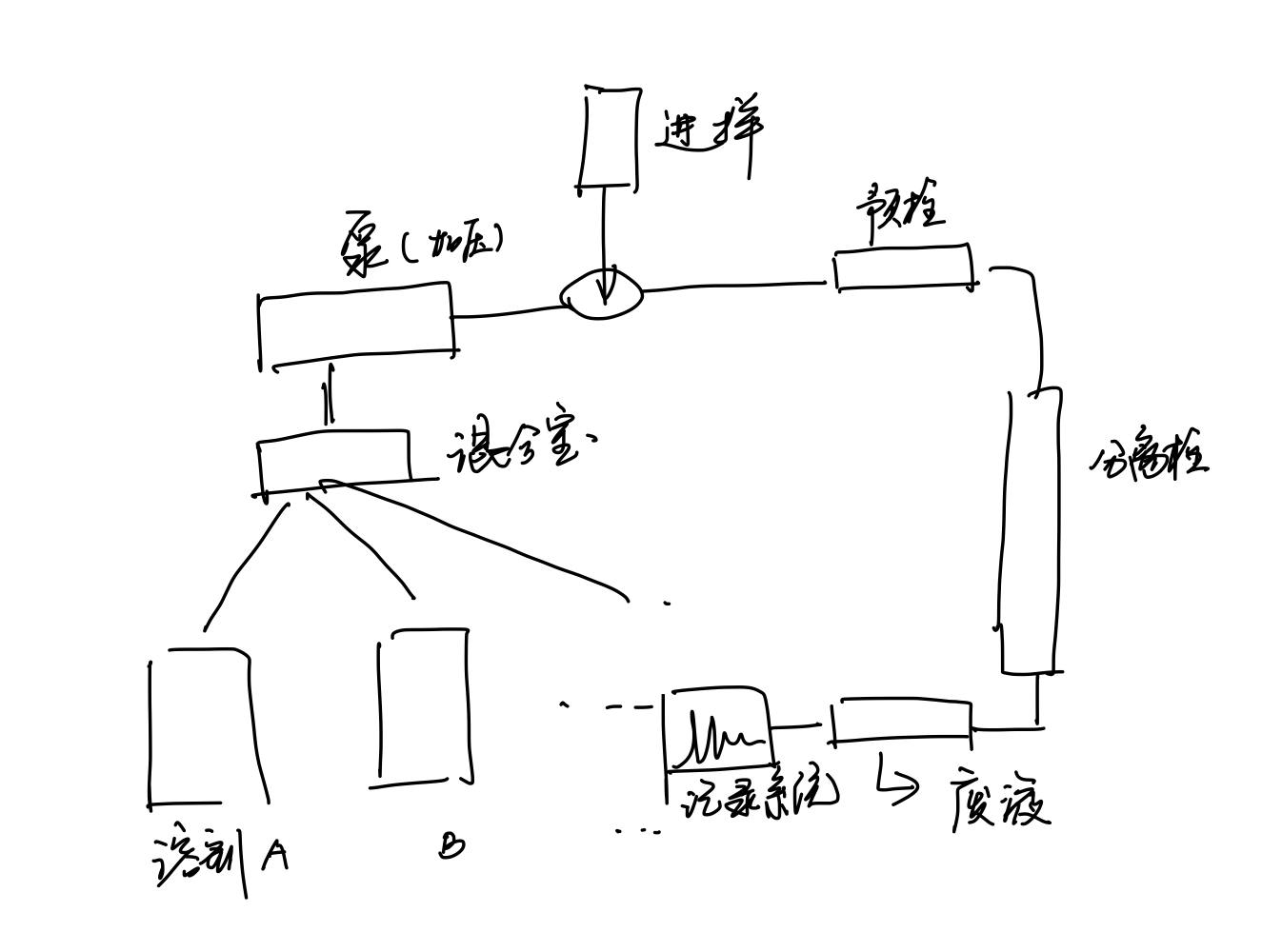
-
溶剂贮存器
-
脱气装置: 柱前, 柱后去除气泡
-
高压输液泵: 需要压力平稳, 脉冲小, 流量稳定可靠, 耐腐蚀性
梯度洗脱装置(包含在高压泵中)
通过不断地变化流动相的强度, 来调整混合样品中各组分的K值, 使所有谱带都以最佳平均K值生成.
-
进样装置:
六通阀进样装置(保证了进样量的稳定性) -
高效分离柱: 内径1~6mm, 柱长5~40cm, 不锈钢管.
-
检测器装置:
-
紫外检测器: 应注意检测器波长应在溶剂的紫外截止波长以内, 否则将干扰组分的检测
-
二极管阵列检测器
-
荧光检测器
-
示差折光率检测器
-
电化学检测器
-
-
性能比较: [TODO], PPT表格
-
几种特殊的检测器:
- 蒸发光散射检测器
液-固色谱¶
利用吸附能力不同进行分离
分为极性和非极性两类.
极性大的试样用极性较强的流动相, 反之用极性低的流动相.
溶剂极性强弱可以用溶剂强度参数\varepsilon^0表示.
液-液色谱¶
正相键和相 反相键和相色谱
当流动相极性小于固定相, 称作 正相色谱
反之, 称为 反相色谱
反相键和相色谱在现代液相色谱中应用最为广泛.
反相键合色谱法
-
以水为溶剂, 易调控, 紫外截止波长低
-
反相键合相色谱中, 极性大的组分先流出, 极性小的组分后流出.
离子交换色谱¶
-
固定相: 阴, 阳离子交换树脂
-
流动相: 盐类的缓冲溶液(pH, 类型, 离子强度)
-
基本原理: (离子型)组分在固定相上反复发生离子交换反应, 组分因与离子交换剂之间亲和力的大小不同而分离, 亲和力大, 保留时间长.
-
应用: 离子及可解离的化合物, 氨基酸, 核酸等.
固定相(交换树脂):分为 阳离子交换树脂(能和阳离子交换的基团, -SO_3H, $-COOH $) 和阴离子交换基团([TODO], PPT)
流动相(缓冲溶液): 改变pH或缓冲盐种类, 离子强度调节离子选择性.
如何测量各个离子的条带?
-
紫外检测: 通常需要有不饱和键, 不适合
-
电导法: 选择性差, 必须先分离各种金属离子(屏蔽 抑制)
抑制柱
[TODO]原理:
抑制柱的再生: 强酸/强碱溶液冲洗->离子交换膜管壁化学法连续再生->电化学连续再生(电解水)
[TODO]PPT电化学再生抑制器原理图
尺寸排阻色谱(凝胶色谱法)
固定相: 凝胶(具有一定大小孔隙分布的高分子表面惰性材料)
原理: 小分子可以扩散到凝胶孔隙, 出峰最慢; 中等分子只能通过部分, 中速通过; 大分子被排斥在外, 最快通过.
应用: 生物分子除盐, 换溶剂
亲和色谱
原理: 利用生物大分子和固定相表面存在的某种特异性亲和力, 进行选择性分离.
[TODO]PPT 根据组分特点选择分离的方式
超临界流体色谱Supercritical fluid Chromatography¶
超临界流体性质
-
性质介于液体和气体之间, 具有气体的低粘度, 液体的高密度, 扩散系数介于两者之间
-
可通过改变SF的密度(程序变压)调节组分分离(SF的密度与压力有关)
-
[TODO]
组成与特性¶
流动相: 超临界流体; CO_2, N_2O NH_3
-
SFC比HPLC的柱效高, 分离速度快
-
SFC比GC的柱温低
使用范围:
-
受热易分解的
-
含量低, 紫外不敏感
-
高分子量, 难以气化
毛细管电泳法¶
在电解质溶液中, 位于电场中的带电粒子在直流电场的作用下, 向其所带电荷相反的电极方向迁移的现象, 称为电泳.
电泳分为自由电泳与区带电泳(可用于分离)两类, 区带电泳又称电色谱.
传统电泳技术包括: 滤纸电泳, 琼脂电泳, 聚丙烯酰胺电泳
高效毛细管电泳分析 High Performance Capillary Electrophoresis(HPCE)
电渗现象与电渗流¶
毛细管中的电渗流的特点
由于毛细管带负电, 其吸引溶液中的阳离子, 形成双电层
双电层中离子强度变高, 电阻小, 阳离子整体移动, 带动溶剂, 导致阴离子同样向负极移动
在电渗流中, 阳离子, 中性离子, 阴离子先后到达检测器.
利用中性分子出峰时间可以测定电流迁移速率.
改变电渗流方向的方法:
-
毛细管材料->不同材料毛细管的表面电荷特性不同,改性
-
电场强度->电渗流速度正比于工作电压
-
缓冲溶液的pH和离子强度
影响毛细管电泳分离的因素¶
- 离子迁移率U(即单位电位梯度下离子迁移的速度, 也叫淌度, ionic mobility)决定于离子的电荷,质量, 水合半径等, 对电荷相同的两种离子A和B, 其电泳距离\Delta d = d_A - d_B = (U_A - U_B) tv/L.
离子迁移度差异大, 电压梯度大, 迁移时间长, 则\Delta d大.
- 组分电离度
电离度不同的分子, 其在电场下的迁移速率也不同. 调节合适的pH, 能够使不同组分间电离度与迁移速率差别最大, 提高分离效率.(蛋白质分离)
- 配体结合
配体的结合能够改变分子,离子的电性.
胶束电动毛细管色谱 Micellar ElectroKinetic Capillary Chromatography¶
解决中性分子不能被毛细管电泳分离的问题.
利用表面活性剂形成胶束作为"准固定相", 通过中性分子在水相与胶束中分配系数的不同, 在电泳过程中对组分进行分离的方法.
中性分子在胶束相和溶液相之间想分配, 分配比可以表示为
光学分析法¶
导论¶
-
线状光谱: 发射的光的粒子之间完全分离, 则产生不连续的特定波长的线状光谱 -
连续光谱: 粒子彼此靠近或者由许多能量相差很小的能级之间的激发产生的光谱.
发射种类¶
-
热辐射
-
气体辐射
-
X射线
-
荧光和磷光
比尔定律
A = \lg (I_0/I) = \lg(1/T) = \varepsilon bc
A为吸收度
T为透光度, 为透射光强度/入射光强度
反射¶
散射¶
- 瑞丽散射
弹性碰撞
- 拉曼散射
非弹性碰撞 发生能量交换
粒子的能级分布¶
若体系在某一温度下达到平衡状态, 则处在激发态能级上的粒子分数可以由波尔兹曼方程给出:
N_i为激发态能级上的粒子浓度, g_i, g_0分别为激发态和基态能级的统计权重, 它表示相同能级的数目, E_i为激发电位.
光学分析法分类¶
分为光谱法和非光谱法.
光谱法: 发生能量变化.
非光谱法: 基于光与物质作用时测量光的性质, 如折射, 反射等.
原子发射光谱¶
量子数
主量子数
角量子数
磁量子数
自旋量子数
谱线强度¶
E是激发能量, g是统计权重, g = 2J+1
影响谱线强度的因素:
-
统计权重
-
跃迁概率
-
激发电位
-
激发温度
-
基态原子数
结论: 当温度一定时, 发射出的谱线光强与浓度成正比.
谱线的自吸和自蚀¶

光源¶
-
直流电弧: 适合定性 不适合定量
-
交流电弧: 半定量分析
-
电感耦合等离子体(Inductively Coupled Plasma)光源
原子吸收光谱¶
原子谱线宽度形成原因¶
-
自然宽度
-
多普勒变宽
-
压力变宽: 同种/不同种离子碰撞
测量方式: 积分->峰值
Lec 13 紫外-可见吸收光谱法¶
研究光谱区间: 200-800nm
连续光谱成因
-
分子整体平动+转动
-
分子内部原子振动
-
电子运动
分子具有多种能级, 联系紧密, 难以分辨, 从而形成连续光谱.
特点¶
-
连续的带状光谱
-
选择性: \lambda A 不同
-
相似性: 产生吸收的共轭基团相同的不同分子, 紫外-可见吸收光谱相似
-
不同浓度的同一种物质, 曲线相似, 峰值与浓度正相关.
溶剂的选择
不存在吸收峰/吸收峰不在观测的波长范围内->避免掩盖待测物.
生色团: 有共轭双键的基团¶
加和效应: 多个生色团被一个以上的单键隔开, 吸收可以加和起来
共轭效应: 形成大\pi共轭体系, 成键和反键轨道都降低, 各自的吸收带消失, 产生一个吸收强度增加的, 波长增大的吸收带.
助色团: p-\pi共轭作用, 效果类似共轭效应.
红移和蓝移
溶剂效应:
-
溶剂从非极性->极性, 精细结构消失(使振动能级变宽)
-
溶剂极性增大, 溶剂与分子的作用力越强, 则能级越低.
溶剂极化后, \Delta n > \Delta \sigma^*, \Delta\pi^* > \Delta\sigma,\Delta \pi
这与分子不同轨道的极性有关.
结论: 极性增加, \pi-\pi^*跃迁能量减小, 红移; n-\pi^*跃迁能量增大, 蓝移.
空间效应: 共轭有机物处于同一平面时, 各生色团之间的相互作用大, 激发能降低, 吸收较长波长的光, 且强度增大.
pH值: 含有酸性基团时, 在碱介质中吸收红移; 含有碱性基团时, 在酸介质中吸收蓝移.
氢键
吸收定律¶
成立条件:
-
单色光
-
均匀介质中
-
吸光物质间无相互作用
加和性: A = \varepsilon_1 bc_1 + \varepsilon_2 bc_2 + \cdots
比尔定律的局限性
-
稀溶液(<0.01mol/L)
-
\varepsilon与浓度无关, 但与折射率有关.
-
反射作用
-
浓度高时, 各吸光质点相互作用.
-
化学因素: 电离 配位
-
仪器因素
定量分析的讨论
-
溶剂及参比溶液
-
波长(波峰的干扰~\varepsilon的稳定性)
-
下缝宽度(光强~光的单色性)
双波长法¶
某共存组分光谱重叠干扰时
吸光度测量误差¶
结论: 在透光率接近0或100\%时, 误差较大
示差分光光度法¶
改变调零或者调\infty的参比溶液, 以消除溶液浓度过低或过高带来的系统误差.
Lec 14 分子发射发光谱 Molecular luminescence spectrometry¶
吸收光谱与发射光谱的比较
吸收光谱是在最大光强的背景下测量因为吸收后导致的光强下降, 而发射光谱是在几乎无光强的背景下测量因为发射而产生的光强, 前者更加容易产生噪声. 因此吸收光谱的检出限较高, 灵敏度较低.
单重态 多重态
M = 2S + 1
-
单重基态S0
-
单重激发态S
-
三重激发态T
分子去激发过程¶
-
振动弛豫
-
内转换
-
外转换
-
系间跨越
荧光的发射弛豫时间远小于磷光的弛豫时间.
发光的量子效率\Phi = {K_f\over K_f + \sum K_i}
分子发射光谱的特点¶
-
斯托克斯位移: 荧光发射波长总是比激发光的波长长, 位移反映了荧光激发与发射间产生的能量差距
-
镜像对称规则: 荧光光谱的形状和吸收光谱相似
发射光谱和吸收光谱的点 分子振动模式相似
-
发射光谱的形状与激发波长的选择无关
影响荧光强度的因素¶
整体规则: 吸光能力越强, 荧光能力也越强
-
结构: 共轭体系
-
跃迁类型: \pi-\pi^*跃迁
-
取代基效应: 给电子基团荧光增强, 吸电子基团荧光减弱(可做荧光开关)
-
结构刚性效应: 平面刚性结构有利于荧光发射(振动弛豫和外转换的概率下降)[ 重要条件 ]
-
环境因素:
-
溶剂的极性: 改变跃迁所需的能量
-
温度: T升高, 荧光,磷光减弱
-
pH: 酸性或碱性荧光物质影响大
-
荧光淬灭: 与溶剂或其他分子作用, 荧光减弱
分为动态淬灭(碰撞)和静态淬灭(形成不发光物)
-
内滤作用: 溶液中存在吸收激发光或发射光的物质, 导致荧光减弱, 称为内滤(自吸是一种内滤)
-
散射光对荧光分析的影响
-
瑞丽散射: 弹性碰撞, 仅改变光子的运动方向, 概率更大.
-
拉曼散射: 非弹性碰撞, 光子与分子发生非弹性碰撞, 运动方向和能量都发生改变.
磷光光谱法¶
产生: 经过系间跨越由单重态转变为三重态后发光.
特点: 发光时间长, 室温下很少观察到磷光, 一般在液氮温度下检测.
化学发光¶
类型:
-
直接化学发光: 产物发光
-
间接化学放光: 产物能量传递给发光分子.
Lec 15 红外光谱吸收法¶
仪器介绍¶
红外光谱仪: 色散型红外光谱仪, 傅里叶变换红外光谱仪
吸收池: 透过红外光的NaCl, KBr, CsI等.
为什么不用石英, 不用Na2SO4?
玻璃石英中含有Si-O, Si-Si键, 对待测物的红外吸收有干扰
其他离子同理.